
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.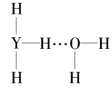 B.
B. 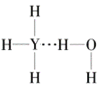 C.
C.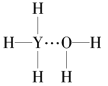 D.
D.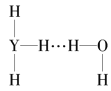
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
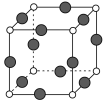
【答案】3d104s1 N>O>C 高于 NH3分子间形成氢键 sp3 正四面体 B ![]()
【解析】
X、Y、Z、W为原子序数递增的短周期主族元素,基态W原子价层电子排布式为nsn-1npn-1,则n=3,W为Si元素,X与W为同主族元素,则X为C元素;Y的最高价氧化物的水化物是强酸,且原子序数大于C小于Si,则Y为N元素;Z元素基态原子中有2个未成对电子,原子序数大于C小于Si,则其核外电子排布应为1s22s22p4,为O元素;基态R原子M能层全充满且核外有且仅有1个未成对电子,价层电子排布为3d104s1,R为Cu元素。
(1)根据分析可知R为Cu元素,基态Cu原子的核外电子排布式为ls22s22p63s23p63d104sl,其核外价层电子排布式为3d104s1;
(2)同一周期,从左到右,元素的第一电离能呈增大趋势,但N原子的2p为半充满,较稳定,第一电离能大于O,所以三种元素的第一电离能从大到小的顺序为N>O>C;
(3)NH3分子间形成氢键,导致氨气的沸点大于甲烷;NH3分子中N原子价层电子对数为![]() =4,采用sp3杂化;X为C元素,其简单氢化物为甲烷,甲烷为正四面体结构;
=4,采用sp3杂化;X为C元素,其简单氢化物为甲烷,甲烷为正四面体结构;
(4)氢键可以表示为X-H…Y,氨气溶于水生成NH3H2O,能够电离生成铵根离子和氢氧根离子,因此其氢键最可能的形式为是由氨气分子中N原子与水分子中的H原子之间形成,所以选C;
(5)R为Cu元素,晶胞中N原子的个数为![]() =1,Cu原子的个数为
=1,Cu原子的个数为![]() =3,所以晶胞的质量为
=3,所以晶胞的质量为![]() g,晶胞边长为acm,则晶胞的体积V=a3cm3,所以晶胞的密度为
g,晶胞边长为acm,则晶胞的体积V=a3cm3,所以晶胞的密度为![]() gcm-3。
gcm-3。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO是两性氧化物,ZnO在NaOH溶液中转化成[Zn(OH)4]2-的离子方程式为_____________________________________________________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
反应Ⅰ ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) △H1
Zn(g)+CO2(g) △H1
反应Ⅱ 2 Zn(g)+ O2(g)=2 ZnO(s) △H2
①上图中的“冷凝物”为________(填化学式)。
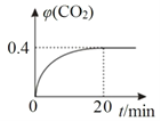
②某温度时,在反应Ⅰ的反应炉中,起始时c(CO)为0.3 molL-1,反应过程中CO2的体积分数φ(CO2)如图所示,则反应Ⅰ的平衡常数K=_______________。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大ZnO的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1 mol 电子,反应放热 174 kJ,则△H2=_____________。
(3)测定氧化锌样品纯度:称取0.5000 g样品,酸溶后定容于250 mL容量瓶中,摇匀。量取25.00 mL 该溶液,用0.04000 molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应方程式为Zn2++H2Y2-=ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液15.12 mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将__________(填“偏高”、“偏低”或“不变”)。
②样品纯度为___________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同;甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知液NaOH溶液放入滴定管进行滴定。
(1)甲同学使用的是_______滴定管,乙同学使用的是________滴定管。
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管在用蒸馏水洗净后也没有用待测NaOH溶液润洗,其余操作均正确,这样甲同学测定结果________(偏大、偏小、无影响,下同),乙同学测定结果__________。
(3)乙同学选择酚酞作指示剂进行试验,如何来判断滴定终点:____________。
(4)甲同学根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据计算c(NaOH)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、均可溶于水的固体,组成它们的离子有
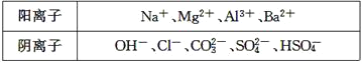
分别取它们的水溶液进行实验。结果如下:
①a溶液与b溶液反应生成白色沉淀,沉淀可溶于e溶液;
②a溶液与c溶液反应生成白色沉淀,沉淀可溶于e溶液;
③a溶液与d溶液反应生成白色沉淀,沉淀可溶于盐酸;
④b溶液与适量d溶液反应生成白色沉淀,加入过量d溶液,沉淀量减少,但不消失。据此推断( )
A.e溶液中一定含有HSO4-
B.a溶液中一定含有Al3+
C.d溶液中一定有SO42-
D.c溶液中可能含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)![]() SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是

A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.配制一定物质的量浓度的![]() 溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.![]() 溶液的物质的量浓度为
溶液的物质的量浓度为![]() ,用水稀释到物质的量浓度为
,用水稀释到物质的量浓度为![]() ,需要水
,需要水![]()
C.配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入![]() 的容量瓶中,加入
的容量瓶中,加入![]() 溶解,振荡摇匀
溶解,振荡摇匀
D.将![]() 溶解在
溶解在![]() 水中,配制溶质质量分数为10%的
水中,配制溶质质量分数为10%的![]() 溶液
溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com