
����Ŀ��X��Y��Z��W���������������ת����ϵ�����и�X��WΪ���ʣ�Y��ZΪ�����δ�г���Ӧ��������
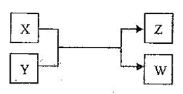
��.��Z�������г��õĵ�ζƷ��W��������Һ��������
��ҵ��Z�ж�����;���û�ѧ����ʽ��ʾZ��һ����;��________________��
���������õ�Z�����˵���أ�����X��Y��Һ��Ӧʱ���Եõ�һ�ֵ����Σ��˷�Ӧ�����ӷ���ʽ��________________��
��.��X�ǹ�ҵ���������Ľ������ʣ�Z��һ�־��д��Եĺ�ɫ���壬��:
��1��X��Y��Ӧ�Ļ�ѧ����ʽ��________________��
��2����������װ��ֻ����Z+W��X+Y��Ӧ���г�װ��δ��������
����ɴ�ʵ���жಽ���������������ǣ�
A����ȼ�ƾ��� B���μ����� C���������崿��
�������������Ⱥ�˳���� ������ĸ����
��Ϊ��֤ʵ��ɹ�������װ����Ҫ�Ľ����������������������� ��
��3����3.38gZ����50ml4mol/L ϡHNO3�г�ַ�Ӧ������112ml��NO����״��������Ӧ�����Һ�еμ�NaOH��Һ�ܲ��������������������ʱ��������Ҫ����2mol/L��NaOH��Һ__________ml.����ȷ��0.1����
���𰸡���: ��1��2 NaCl +2H2O![]() H2��+ Cl2�� + 2NaOH ��
H2��+ Cl2�� + 2NaOH ��
��2��3Cl2+I-+3H2O��6Cl-+IO3-+6H+��
������1��3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
��2����b c a �����ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3��97.5��
��������
���������I����1��W��������Һ�������Ƴ�WΪI2��XΪ���ʣ���Z������õ�ζƷ�����XΪCl2��YΪNaCl���ٵ�ⱥ��ʳ��ˮ���õ�NaOH��H2��Cl2����Ӧ����ʽΪ��2 NaCl +2H2O![]() H2��+ Cl2�� + 2NaOH �������ƼNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl����Cl2�������������ϼ���0������1��,KI��I�ɣ�1������5�ۣ����ݻ��ϼ۵�������������ƽ��������ӷ�Ӧ����ʽΪ��3Cl2+I��+3H2O��6Cl��+IO3��+6H����II.X�ǹ�ҵ���������Ľ������ʣ�XΪ����Z��һ�־��д��Եĺ�ɫ���壬ZΪFe3O4����1�������ķ�Ӧ������ˮ�����ķ�Ӧ���䷴Ӧ����ʽΪ��3Fe+4H2O
H2��+ Cl2�� + 2NaOH �������ƼNaCl��CO2��NH3��H2O=NaHCO3����NH4Cl����Cl2�������������ϼ���0������1��,KI��I�ɣ�1������5�ۣ����ݻ��ϼ۵�������������ƽ��������ӷ�Ӧ����ʽΪ��3Cl2+I��+3H2O��6Cl��+IO3��+6H����II.X�ǹ�ҵ���������Ľ������ʣ�XΪ����Z��һ�־��д��Եĺ�ɫ���壬ZΪFe3O4����1�������ķ�Ӧ������ˮ�����ķ�Ӧ���䷴Ӧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2����2���������ǿ�ȼ�����壬��Ҫ�ų�װ���п�������ֹ����Σ�գ���Ҫ���������Ĵ��ȣ��ڵ�ȼ�ƾ��ƣ���˲�����bca����������лӷ��ԣ������л���HCl����ʵ��������ţ������ȥ������HCl������ˮ������ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3���������ʱ����Һ������ֻ��NaNO3������Ԫ���غ㣬n��NaOH�� = n��NaNO3�� = ��50 �� 10��3 �� 4 �� 112 �� 10��3 /22.4�� mol = 0.195 mol��v��NaOH�� = 0.195/2L = 0.0975L,��97.5ml��
Fe3O4+4H2����2���������ǿ�ȼ�����壬��Ҫ�ų�װ���п�������ֹ����Σ�գ���Ҫ���������Ĵ��ȣ��ڵ�ȼ�ƾ��ƣ���˲�����bca����������лӷ��ԣ������л���HCl����ʵ��������ţ������ȥ������HCl������ˮ������ڼס���װ���м�����һ��װ��ˮ��ϴ��ƿ����3���������ʱ����Һ������ֻ��NaNO3������Ԫ���غ㣬n��NaOH�� = n��NaNO3�� = ��50 �� 10��3 �� 4 �� 112 �� 10��3 /22.4�� mol = 0.195 mol��v��NaOH�� = 0.195/2L = 0.0975L,��97.5ml��


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
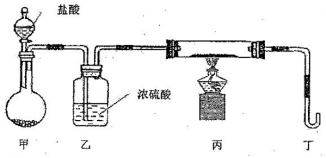
����Ŀ����ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ����ͼ1����Ҫ�������£�
����1 ����ƿ��װ��10 gþм��150 mL��ˮ���ѣ�װ��B�м���15 mLҺ�塣
����2 ����ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3 ��Ӧ��Ϻ�ָ������£����ˣ���Һת������һ�������ƿ�У���ȴ��0�����������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4 �������ñ��ܽ��Ʒ����ȴ��0�����������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160 ���ֽ����ˮMgBr2��Ʒ��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԡ�
��MgBr2+3C2H5OC2H5![]() MgBr2��3C2H5OC2H5
MgBr2��3C2H5OC2H5
��ش�
��1������A��������____________��ʵ���в����ø�������������N2��ԭ����___________��
��2���罫װ��B��Ϊװ��C(ͼ2)�����ܻᵼ�µĺ����___________��
��3������3�У���һ�ι��˳�ȥ��������___________��
��4���йز���4��˵������ȷ����___________��
A������95%���Ҵ����汽�ܽ��Ʒ
B��ϴ�Ӿ����ѡ��0���ı�
C��������160������ҪĿ���dz�ȥ��
D���ò����Ŀ���dz�ȥ���ѺͿ��ܲ�������
��5��Ϊ�ⶨ��Ʒ�Ĵ��ȣ�����EDTA(��дΪY4-)����Һ�ζ�����Ӧ�����ӷ���ʽ��
Mg2++Y4-=MgY2-
���ζ�ǰ��ϴ�ζ��ܵIJ���������__________��
���ⶨǰ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����0.0500 mol��L-1��EDTA����Һ�ζ����յ㣬����EDTA����Һ26.50 mL��������ˮMgBr2��Ʒ�Ĵ�����__________________(������������ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
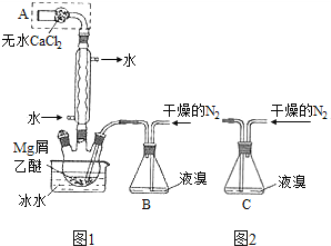
����Ŀ��ij�о���ѧϰС�����ۼס��ҡ���������������װ�õ��й��÷������в��������ǣ� ��
A����װ�ã�������֤��̼�ķǽ����Աȹ�ǿ

B����װ�ã���Ƥ�ܵ���������ʹˮ˳������

C����װ�ã���ͼʾ�ķ������ܼ���װ�õ�������

D����װ�ã��ȴӢٿڽ�������������̼���ٴӢڿڽ��������ռ�NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL MgCl2��AlCl3�Ļ����Һ�У�c(Mg2+)=0.2mol/L��c(Cl)=1.3mol/L����Ҫʹ���е�Mg2+ȫ��ת��Ϊ���������������������Ҫ4mol/L��NaOH��Һ�����Ϊ( )
A��120mL B��80mL C��40mL D��20mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ������������������ѧ����е���ܣ����Ӧ�ù㷺�������������ںϽ����
A. ���� B. ˮ�� C. ˮ�� D. ���ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ࡢ�����ʡ���֬��ά���ص�˵���У���ȷ����( )
A�����ǵ���ɶ�����C��H��O��N��Ԫ��
B����һ�������£����Ƕ��ܷ���ˮ�ⷴӦ
C��������Ҫ�Ķ�ʮ���ְ����ᣬ������ͨ�����������ϳ�
D����֬���Ǹ�֬����ĸ���������һ�ָ�����Ӫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڼ���MgCl2��Al2(SO4)3������Һ���Լ���
A. ��ˮ B. H2SO4��Һ C. NaOH��Һ D. HNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�����

��֪���ٷ�Ӧ![]() �ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
��I��һ�ֳ������������壬����![]() ���Է�����Ӧ��2E��I 2F��D��F�е�EԪ�ص���������Ϊ60%.�ش����⣺
���Է�����Ӧ��2E��I 2F��D��F�е�EԪ�ص���������Ϊ60%.�ش����⣺
��1�����з�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��2���������ĵ���ʽΪ________________,���Ŀռ乹����_________��
��3��1.6g G �������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ����������ͭ�۵�����Ϊ g��
��4��C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________����Ӧ����Һ������������Ӧ�����ӷ���ʽ��__________________;
��5��ʵ������һ�����I���ڵ��Լ��ͷ�������___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������еĻ��ţ�CH3��CH2��![]() ��
��![]() �е�̼ԭ�ӣ��ֱ��Ϊ�����١��塢��̼ԭ�ӣ���Ŀ�ֱ���nl��n2��n3��n4��ʾ��
�е�̼ԭ�ӣ��ֱ��Ϊ�����١��塢��̼ԭ�ӣ���Ŀ�ֱ���nl��n2��n3��n4��ʾ��
���磺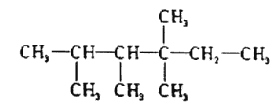 �����У�nl=6��n2=1��n3=2��n4=1�����������������⣩�����У��������͵�ԭ�Ӹ���֮�������һ���Ĺ�ϵ���Ը��ݲ�ͬ��������ɺͽṹ���������������������⣩�и�ԭ�����Ĺ�ϵ��
�����У�nl=6��n2=1��n3=2��n4=1�����������������⣩�����У��������͵�ԭ�Ӹ���֮�������һ���Ĺ�ϵ���Ը��ݲ�ͬ��������ɺͽṹ���������������������⣩�и�ԭ�����Ĺ�ϵ��
��1��������������ԭ����ΪA��A��nl��n2��n3��n4�Ĺ�ϵ�ǣ�A=_________����A=_________��
��2������̼ԭ����֮��Ĺ�ϵΪnl=____________��
��3����ij������n2=n3=n4=1��д���÷��ӵĽṹ��ʽ�ͼ���ʽ�����������������___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com