
¡¾̀âÄ¿¡¿ÏÂͼÖĐ£¬A¡¢B¡¢C¡¢D¡¢EÊǵ¥ÖÊ£¬G¡¢H¡¢I¡¢FÊÇB¡¢C¡¢D¡¢E·Ö±đºÍAĐγɵĶ₫Ôª»¯ºÏÎï¡£

̉ÑÖª£º¢Ù·´Ó¦![]() Äܷųö´óÁ¿µÄÈÈ£¬¸Ă·´Ó¦ÔøÓ¦ÓĂÓÚ̀ú¹́µÄº¸½Ó£»
Äܷųö´óÁ¿µÄÈÈ£¬¸Ă·´Ó¦ÔøÓ¦ÓĂÓÚ̀ú¹́µÄº¸½Ó£»
¢ÚIÊÇ̉»ÖÖ³£¼ûµÄÎÂỂÆø̀壬ËüºÍ![]() ¿É̉Ô·¢Éú·´Ó¦£º2E£«I 2F£«D£¬FÖеÄEÔªËصÄÖÊÁ¿·ÖÊưΪ60%.»Ø´đÎỀ⣺
¿É̉Ô·¢Éú·´Ó¦£º2E£«I 2F£«D£¬FÖеÄEÔªËصÄÖÊÁ¿·ÖÊưΪ60%.»Ø´đÎỀ⣺
£¨1£©¢ÙÖĐ·´Ó¦µÄ»¯Ñ§·½³̀ʽΪ_____________________£»
£¨2£©»¯ºÏÎï¢ñµÄµç×ÓʽΪ________________,ËüµÄ¿Ơ¼ä¹¹ĐÍÊÇ_________£»
£¨3£©1.6g G ÈÜÓÚÑÎËᣬµĂµ½µÄÈÜ̉ºÓëÍ·ÛÍêÈ«·´Ó¦£¬ÖÁÉÙËùĐèÍ·ÛµÄÖÊÁ¿Îª g£»
£¨4£©CÓë¹ưÁ¿NaOHÈÜ̉º·´Ó¦µÄÀë×Ó·½³̀ʽΪ_____________£¬·´Ó¦ºóÈÜ̉ºÓë¹ưÁ¿»¯ºÏÎï¢ñ·´Ó¦µÄÀë×Ó·½³̀ʽ£º__________________;
£¨5£©ÊµÑéỂÖĐ̉»°ă¼́ÑéI´æÔÚµÄÊÔ¼ÁºÍ·½·¨ÊÇ£º___________________¡£
¡¾´đ°¸¡¿£¨1£©![]()
£¨2£©![]() Ö±ÏßĐÍ£¨3£©0.64g
Ö±ÏßĐÍ£¨3£©0.64g
£¨4£©2Al£«2OH££«2H2O=2AlO2££«3H2¡ü AlO2££«CO2£«2H2O=HCO3££«Al£¨OH£©3¡ư
£¨5£©ÊÔ¼Á£º³ÎÇåʯ»̉Ë® ·½·¨£º°ÑCO2ͨÈë³ÎÇåʯ»̉Ë®ÖĐ£¬ÈôÈÜ̉º³öÏÖ»ë×Ç˵Ă÷ÓĐCO2´æÔÚ¡£
¡¾½âÎö¡¿
ÊỒâ·ÖÎö£º![]() Äܷųö´óÁ¿µÄÈÈ£¬¸Ă·´Ó¦ÔøÓ¦ÓĂÓÚ̀ú¹́µÄº¸½Ó£»¸Ă·´Ó¦ÊôÓÚÂÁÈÈ·´Ó¦£¬½đÊôÂÁºÍÖؽđÊôÑơ»¯Îï·´Ó¦ÖĂ»»ÖؽđÊô£»IÊÇ̉»ÖÖ³£¼ûµÄÎÂỂÆø̀壬ËüΪCO2£¬ËüºÍ
Äܷųö´óÁ¿µÄÈÈ£¬¸Ă·´Ó¦ÔøÓ¦ÓĂÓÚ̀ú¹́µÄº¸½Ó£»¸Ă·´Ó¦ÊôÓÚÂÁÈÈ·´Ó¦£¬½đÊôÂÁºÍÖؽđÊôÑơ»¯Îï·´Ó¦ÖĂ»»ÖؽđÊô£»IÊÇ̉»ÖÖ³£¼ûµÄÎÂỂÆø̀壬ËüΪCO2£¬ËüºÍ![]() ¿É̉Ô·¢Éú·´Ó¦£º2E£«I =2F£«D£¬E D¶¼Êǵ¥ÖÊ¡¢¸Ă·´Ó¦ÎªÖĂ»»·´Ó¦£¬ÓëCO2·¢ÉúÖĂ»»·´Ó¦µÄ³£¼ûΪ½đÊôĂ¾£¬Ç̉MgOÖĐMgÔªËصÄÖÊÁ¿·ÖÊưΪ60%£¬Âú×ăÄÜÓëFÖеÄEÔªËصÄÖÊÁ¿·ÖÊưΪ60%£®Í¨¹ửÔÉÏĐÅÏ¢¿É̉ÔµĂ³öAΪO2 ¡¢B ÊÇ Fe ¡¢ CÊÇ Al¡¢DÊÇ C ¡¢EÊÇMg£¬G ÊÇFe2O3 HÊÇAl2O3 ¡¢IÊÇCO2 FÊÇ MgO£»1.6g Fe2O3£¨ 0.01mol£©ÈÜÓÚÑÎËᣬµĂµ½µÄÈÜ̉ºÓëÍ·ÛÍêÈ«·´Ó¦++Cu=Cu2++2Fe2+ £¬2Fe3---CuµÄ¹Øϵ£¬µĂ³öÏûºÄÍ·ÛµÄÖÊÁ¿Îª0.64g £»
¿É̉Ô·¢Éú·´Ó¦£º2E£«I =2F£«D£¬E D¶¼Êǵ¥ÖÊ¡¢¸Ă·´Ó¦ÎªÖĂ»»·´Ó¦£¬ÓëCO2·¢ÉúÖĂ»»·´Ó¦µÄ³£¼ûΪ½đÊôĂ¾£¬Ç̉MgOÖĐMgÔªËصÄÖÊÁ¿·ÖÊưΪ60%£¬Âú×ăÄÜÓëFÖеÄEÔªËصÄÖÊÁ¿·ÖÊưΪ60%£®Í¨¹ửÔÉÏĐÅÏ¢¿É̉ÔµĂ³öAΪO2 ¡¢B ÊÇ Fe ¡¢ CÊÇ Al¡¢DÊÇ C ¡¢EÊÇMg£¬G ÊÇFe2O3 HÊÇAl2O3 ¡¢IÊÇCO2 FÊÇ MgO£»1.6g Fe2O3£¨ 0.01mol£©ÈÜÓÚÑÎËᣬµĂµ½µÄÈÜ̉ºÓëÍ·ÛÍêÈ«·´Ó¦++Cu=Cu2++2Fe2+ £¬2Fe3---CuµÄ¹Øϵ£¬µĂ³öÏûºÄÍ·ÛµÄÖÊÁ¿Îª0.64g £»


 Ë«»ùͬ²½µ¼º½ÑµÁ·ÏµÁĐ´đ°¸
Ë«»ùͬ²½µ¼º½ÑµÁ·ÏµÁĐ´đ°¸ »Æ¸ÔĐ¡×´ÔªÍ¬²½¼ÆËằ́̀́Á·ÏµÁĐ´đ°¸
»Æ¸ÔĐ¡×´ÔªÍ¬²½¼ÆËằ́̀́Á·ÏµÁĐ´đ°¸
| Ä꼶 | ¸ßÖĐ¿Î³̀ | Ä꼶 | ³ơÖĐ¿Î³̀ |
| ¸ß̉» | ¸ß̉»Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ở» | ³ở»Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ß¶₫ | ¸ß¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ơ¶₫ | ³ơ¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ßÈư | ¸ßÈưĂâ·Ñ¿Î³̀ÍƼö£¡ | ³ơÈư | ³ơÈưĂâ·Ñ¿Î³̀ÍƼö£¡ |
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿Å¨H2SO4 ĂܶÈ1.84g/mL£¬ÎïÖʵÄÁ¿Å¨¶ÈΪ18.4mol/L£¬ÖÊÁ¿·ÖÊưΪ98%£¬È¡10mLŨH2SO4ºÍa mLË®»́ºÏµĂÎïÖʵÄÁ¿Å¨¶ÈΪC mol/L£¬ÖÊÁ¿·ÖÊưΪb%£®ÏÂÁĐ×éºÏƠưÈ·µÄÊÇ£¨ £©
£¨1£©ÈôC=9.2Ộa£¾10 b£¾49%
£¨2£©ÈôC=9.2Ộa£¾10 b£¼49%
£¨3£©Èôb=49Ộa=18.4 C£¼9.2
£¨4£©Èôb=49Ộa=18.4 C£¾9.2£®
A£®£¨1£©£¨3£© B£®£¨1£©£¨4£© C£®£¨2£©£¨3£© D£®£¨2£©£¨4£©
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿X¡¢Y¡¢Z¡¢WËÄÖÖÎïÖÊÓĐÈçÏÂÏ໥ת»¯¹Øϵ£¨ÆäÖи÷X¡¢WΪµ¥ÖÊ£¬Y¡¢ZΪ»¯ºÏÎδÁĐ³ö·´Ó¦̀ơ¼₫£©¡£
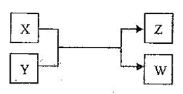
¢ñ.ÈôZÊÇÉú»îÖĐ³£Óõĵ÷ζƷ£¬WÓöµí·ÛÈÜ̉º±äÀ¶£¬Ộ£º
¹¤̉µÉÏZÓжàÖÖÓĂ;£¬ÓĂ»¯Ñ§·½³̀ʽ±íʾZµÄ̉»ÖÖÓĂ;£º________________¡£
Éú»îÖĐËùÓõÄZ¼ÓÈëÁ˵âËá¼Ø£¬¹ưÁ¿XÓëYÈÜ̉º·´Ó¦Ê±¿É̉Եõ½̉»ÖÖµâËáÑΣ¬´Ë·´Ó¦µÄÀë×Ó·½³̀ʽÊÇ________________¡£
¢̣.ÈôXÊǹ¤̉µÉÏÓĂÁ¿×î´óµÄ½đÊôµ¥ÖÊ£¬ZÊÇ̉»ÖÖ¾ßÓĐ´ÅĐԵĺÚÉ«¾§̀壬Ộ:
£¨1£©XÓëY·´Ó¦µÄ»¯Ñ§·½³̀ʽÊÇ________________¡£
£¨2£©ÈôÓĂÏÂÁĐ×°ÖĂÖ»½øĐĐZ+W¡úX+Y·´Ó¦£¨¼Đ³Ö×°ÖĂδ»³ö£©£»
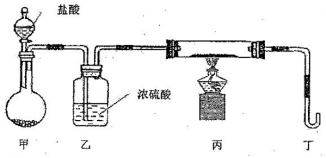
¢ÙÍê³É´ËʵÑéÓĐ¶à²½²Ù×÷£¬ÆäÖĐÈư²½ÊÇ£º
A£®µăȼ¾Æ¾«µÆ B£®µÎ¼ÓÑÎËá C£®¼́ÑéÆø̀å´¿¶È
ƠâÈư²½²Ù×÷µÄÏȺó˳Đ̣ÊÇ £῭î×Öĸ£©¡£
¢ÚΪ±£Ö¤ÊµÑé³É¹¦£¬ÉÏÊö×°ÖĂĐè̉ª¸Ä½ø£¬·½·¨ÊÇ£¨ÓĂÎÄ×ÖĐđÊö£© ¡£
£¨3£©½«3.38gZ¼ÓÈë50ml4mol/L Ï¡HNO3ÖĐ³ä·Ö·´Ó¦£¬²úÉú112mlµÄNO£¨±ê×¼×´¿ö£©£¬Ị̈·´Ó¦ºóµÄÈÜ̉ºÖĐµÎ¼ÓNaOHÈÜ̉ºÄܲúÉú³Áµí¡£µ±³ÁµíÁ¿×î¶àʱ£¬ÖÁÉÙĐè̉ª¼ÓÈë2mol/LµÄNaOHÈÜ̉º__________ml.£¨¾«È·µ½0.1£©¡£
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÏÂÁĐ˵·¨ÖĐ²»ƠưÈ·µÄÊÇ£¨ £©
A. 1 mol ÑơÆøÖĐº¬ÓĐ12.04¡Á1023¸öÑơÔ×Ó£¬ÔÚ±ê×¼×´¿öÏÂƠ¼ÓĐ̀å»ư22.4 L
B. 1 mol³ôÑơºÍ1.5 molÑơÆøº¬ÓĐÏàͬµÄÑơÔ×ÓÊư
C. µÈ̀å»ư¡¢Å¨¶È¾ùΪ1 mol/LµÄÁ×ËáºÍÑÎËᣬµçÀë³öµÄÇâÀë×ÓÊưÖ®±ÈΪ3¡Ă1
D. µÈÎïÖʵÄÁ¿µÄ¸É±ùºÍÆÏ̀Ñ̀Ç£¨C6H12O6£©ÖĐËùº¬̀¼Ô×ÓÊưÖ®±ÈΪ1¡Ă6£¬ÑơÔ×ÓÊưÖ®±ÈΪ1¡Ă3
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿¶ÔijËáĐÔÈÜ̉º£¨¿ÉÄܺ¬ÓĐBr£¡¢SO![]() ¡¢H2SO3¡¢NH
¡¢H2SO3¡¢NH![]() £©·Ö±đ½øĐĐÈçÏÂʵÑ飺
£©·Ö±đ½øĐĐÈçÏÂʵÑ飺
¢Ù¼ÓÈÈʱ·Å³öµÄÆø̀å¿É̉ÔʹƷº́ÈÜ̉ºÍÊÉ«£»
¢Ú¼Ó¼îµ÷ÖÁ¼îĐԺ󣬼ÓÈȷųöµÄÆø̀å¿É̉ÔʹʪÈóµÄº́ɫʯÈïÊÔÖ½±äÀ¶£»
¢Û¼ÓÈëÂÈˮʱ£¬ÈÜ̉ºÂÔÏÔ»ÆÉ«£¬ÔÙ¼ÓÈëBaCl2ÈÜ̉º£¬²úÉúµÄ°×É«³Áµí²»ÈÜÓÚÏ¡ÏơËá¡£
¶ÔÓÚÏÂÁĐÎïÖʲ»ÄÜÈ·ÈÏÆäÔÚÔÈÜ̉ºÖĐÊÇ·ñ´æÔÚµÄÊÇ£¨ £©
A£®Br£ B£®SO![]() C£®H2SO3 D£®NH
C£®H2SO3 D£®NH![]()
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿Î̉ĂÇÈçºÎỞµ½»Ø¼̉µÄ·£¿ÈÙ»ñ2014Äêŵ±´¶ûÉúÀíѧ»̣̉½Ñ§½±µÄÈưλ¿Æѧ¼̉·¢ÏÖ´óÄÔÀïµÄÉñ¾Ï¸°û----¡°Î»ÁDϸ°û¡±ºÍ¡°Íø¸ñϸ°û¡±Æđµ½ÁËÖØ̉ª×÷ÓĂ¡£ÏÂÁĐĐđÊöÖĐƠưÈ·µÄÊÇ
A. ¡°Î»ÁDϸ°û¡±ÏÊÖØÖĐÖÊÁ¿°Ù·Ö±È×î¸ßµÄÔªËØÊÇC
B. ¡°Íø¸ñϸ°û¡± ¸ÉÖØÖĐÖÊÁ¿°Ù·Ö±È×î¸ßµÄÔªËØÊÇO
C. ÉÏÊöÁ½ÖÖϸ°ûÏÊÖØÖĐÔ×ÓÊưÁ¿×î¶àµÄÔªËؾùÊÇH
D. PÓëS·Ö±đÊÇ¡°Î»ÖĂϸ°û¡±ÖеĴóÁ¿ÔªËغÍ΢Á¿ÔªËØ
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÏÂÁĐÊôÓÚÓÍÖ¬µÄÓĂ;µÄÊÇ( )
¢ÙÈËÀàµÄÓªÑøÎïÖÊ ¢ÚÖÆÈ¡·ÊÔí ¢ÛÖÆÈ¡¸ÊÓÍ ¢ÜÖƱ¸ÆûÓÍ£®
A£®¢Ù¢Ú¢Ü B£®¢Ù¢Û¢Ư C£®¢Ú¢Û¢Ü¢Ư D£®¢Ù¢Ú¢Û
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÏÂÁĐ¹ØÓÚº£Ë®×ÊÔ´µÄ˵·¨²»ƠưÈ·µÄÊÇ£¨ £©
A. º£Ë®µ»¯µÄ·½·¨Ö÷̉ªÓĐƠôÁ󷨡¢µçÉøÎö·¨¡¢Àë×Ó½»»»·¨µÈ
B. ´Óº£Ë®ÖĐ¿É̉ỒáÈ¡Ó˺ÍÖØË®µÈºËÔÁÏ
C. º£Ë®ÖеÄäå¡¢·úµÈÔªËؾùΪ΢Á¿ÔªËØ£¬µ«ÈÔÓĐ̀áÈ¡µÄ¼ÛÖµ
D. º£Ë®ÖĐ½đµÄ´¢´æÁ¿Ô¼ÎªÂ½µØµÄ170±¶£¬µ«ËüµÄ¸»¼¯³̀¶ÈÈ´ºÜµÍ
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÑĐ¾¿´óÆøÖĐº¬Ạ́»¯ºÏÎï(Ö÷̉ªÊÇSO2ºÍH2S)µÄת»¯¶Ô»·¾³±£»¤¾ßÓĐÖØ̉ª̉ẩå¡£
(1)SO2µÄ´óÁ¿ÅÅ·Å»á̉ưÆđÑÏÖصĻ·¾³ÎỀâÊÇ £¬³±Êª̀ơ¼₫Ï£¬Đ´³ö´óÆøÖĐSO2ת»¯ÎªHSO3-µÄ·½³̀ʽ
(2)ÍÁÈÀÖеÄ΢ÉúÎï¿É½«´óÆøÖĐH2S¾Á½²½·´Ó¦Ñơ»¯³ÉSO42-£¬Á½²½·´Ó¦µÄÄÜÁ¿±ä»¯Ê¾̉âͼÈçÏ£º
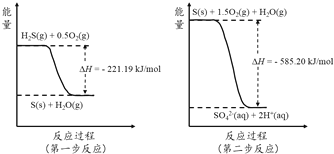
1mol H2S(g)È«²¿Ñơ»¯³ÉSO42-(aq)µÄÈÈ»¯Ñ§·½³̀ʽΪ
(3)SO2ʱ¹¤̉µÖÆẠ́ËáµÄÔÁÏÖ®̉»£¬̉»¶¨Î¶ÈÏ£¬Ị̈ÈƯ»ưΪ2LµÄĂܱƠÈƯÆ÷ÖĐ³äÈë̉»¶¨Á¿µÄSO2ºÍO2£¬·¢Éú·´Ó¦£º2SO2(g)+O2(g) ![]() 2SO3(g),¹ư³̀ÖĐ²â¶¨µÄ²¿·ÖÊư¾Ư¼ûÏÂ±í£º
2SO3(g),¹ư³̀ÖĐ²â¶¨µÄ²¿·ÖÊư¾Ư¼ûÏÂ±í£º
ʱ¼ä/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
¢Ù·´Ó¦ÔÚ0-4minÄÚµÄƽ¾ùËÙÂÊΪv(SO2)= £»
¢Ú´ËζÈϸ÷´Ó¦µÄ»¯Ñ§Æ½ºâ³£ÊưK= ¡£
¢Û8minʱ£¬Î¬³ÖζȲ»±ä£¬Íù·´Ó¦ÈƯÆ÷ÖĐÔÙͨÈë0.020molSO2(g)£¬0.010molO2(g),ÖØĐ´ﵽƽºâʱ»́ºÏÆø̀åÖĐSO2µÄ°Ù·Öº¬Á¿½« (̀î¡°¼ơĐ¡¡±¡¢¡°Ôö´ó¡±»̣¡°²»±ä¡±¡£)
(4)½«H2SºÍ¿ƠÆøµÄ»́ºÏÆø̀åͨÈëFeCl3¡¢FeCl2¡¢CuCl2µÄ»́ºÏÈÜ̉ºÖĐ·´Ó¦»ØÊƠS£¬ÆäÎïÖÊת»¯ÈëÓ̉ͼËùʾ£º
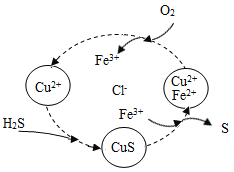
¢ÙÔÚζÈ̉»¶¨ºÍ²»²¹¼ÓÈÜ̉ºµÄ̀ơ¼₫Ï£¬»ºÂưͨÈë»́ºÏÆø̀壬²¢³ä·Ö½Á°è¡£ÓûʹÉú³ÉµÄẠ́µ¥ÖÊÖĐ²»º¬CuS£¬¿É²ÉÈ¡µÄ´ëÊ©ÓĐ ¡£
¢Ú̉»°ăÀ´Ëµ£¬Èç¹û̉»¸ö·´Ó¦µÄƽºâ³£Êư´óÓÚ105£¬Í¨³£ÈÏΪ·´Ó¦½øĐĐµĂ½Ï°²È«£»Ïà·´£¬Èç¹û̉»¸ö·´Ó¦µÄƽºâ³£ÊưÏÄÆƠÓë10-5£¬ỘÈÏΪƠâ¸ö·´Ó¦ºÜÄѽøĐĐ¡£
̉ÑÖª³£ÎÂϸ÷ÎïÖʵÄÈܶȻư¼°µçÀëƽºâ³£Êư£º
CuS£ºKsp=6.3¡Á10£36£»H2S£ºKa1=1.3¡Á10£7£¬Ka2=7.1¡Á10£15£¬
ͨ¹ư¼ÆËă˵Ă÷·´Ó¦CuS(s)£«2H£«(aq)=Cu2£«(aq)£«H2S(aq)½øĐĐµÄ³̀¶È
²é¿´´đ°¸ºÍ½âÎö>>
¹ú¼ÊÑ§Đ£ÓÅÑ¡ - Á·Ï°²áÁбí - ÊỒâÁбí
º₫±±Ê¡»¥ÁªÍøÎ¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨Æ½̀¨ | ÍøÉÏÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | µçĐÅƠ©Æ¾Ù±¨×¨Çø | ÉæÀúÊ·ĐéÎ̃Ö÷̉åÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | ÉæÆóÇÖȨ¾Ù±¨×¨Çø
Î¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨µç»°£º027-86699610 ¾Ù±¨ÓÊÏ䣺58377363@163.com