
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
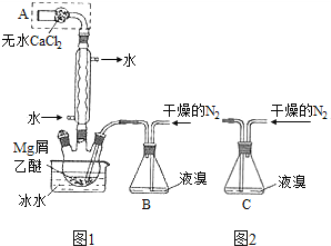
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是__________________(以质量分数表示)。
【答案】
(1)干燥管;防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑(4)BD
(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次;②97.5%
【解析】
试题分析:(1)仪器A为干燥管,本实验要用镁屑和液溴反应生成溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气,故答案为:防止镁屑与氧气反应生成的氧化镁阻碍Mg和Br2的反应,故答案为:干燥管;防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应;
(2)将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,反应可以容易控制防止反应过快,故答案为:会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;
(3)步骤3过滤出去的是不溶于水的镁屑,故答案为:镁屑;
(4)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,故A错误;B.加入苯的目的是除去乙醚和溴,洗涤晶体用0°C的苯,可以减少产品的溶解,故B正确;C.加热至160°C的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,故C错误;D.该步骤是为了除去乙醚和溴,故D正确;故选BD;
(5)①滴定前润洗滴定管是需要从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体湿润内壁,然后从下步放出,重复2-3次,故答案为:从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次;②依据方程式Mg2++Y4-═MgY2-分析,溴化镁的物质的量=0.0500mol/L×0.02650L=0.001325mol,则溴化镁的质量为0.001325mol×184g/mol=0.2438g,溴化镁的产品的纯度=![]() ×100%=97.5%,故答案为:97.5%。
×100%=97.5%,故答案为:97.5%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
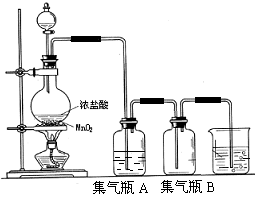
试回答下列问题:
(1)请指出 是氧化剂, _是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水 中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
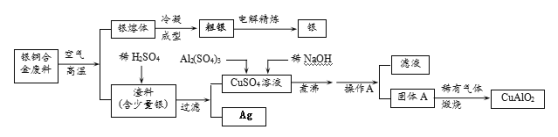
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础.下列关于各实验装置的叙述正确的是( )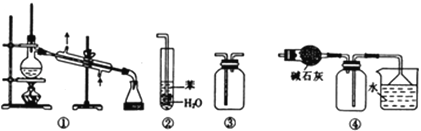
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素和化合物的叙述,正确的是
A. 核糖核酸是染色体和核糖体的主要成分之一
B. 在人体活细胞中氢原子的数目最多
C. 蛋白质区别于脂质的特有元素是氨
D. 核酸、核糖、核苷酸都含有元素C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为____________,R的相对原子质量为____________。
(2)已知CO、CO2的混合气体的质量为15 g,在标准状况下体积为8.8 L,则可推知该混合气体中含CO________ g,所含CO2在标准状况下体积为____________ L。
(3)将4 g NaOH溶于____________g水中,才能使每100个水分子中溶有1个Na+。
(4)同温同压下SO2 与 He密度之比为 ,若质量相等,两种气体的体积之比____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有着重要的应用。下列说法正确的是 ( )
A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
C.白酒中混有少量塑化剂,可通过过滤除去
D.能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂应限量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是( )
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中各X、W为单质,Y、Z为化合物,未列出反应条件)。
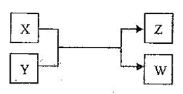
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
工业上Z有多种用途,用化学方程式表示Z的一种用途:________________。
生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是________________。
(2)若用下列装置只进行Z+W→X+Y反应(夹持装置未画出);
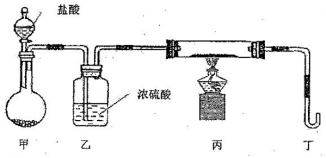
①完成此实验有多步操作,其中三步是:
A.点燃酒精灯 B.滴加盐酸 C.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.38gZ加入50ml4mol/L 稀HNO3中充分反应,产生112ml的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2mol/L的NaOH溶液__________ml.(精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com