
【题目】实验是化学研究的基础.下列关于各实验装置的叙述正确的是( )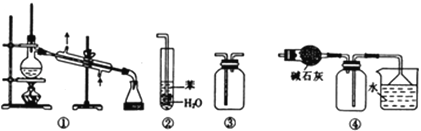
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验基本操作中正确的是( )
A.用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平
B.稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌
C.用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁
D.用托盘天平称量物质时,称量物放在右盘,砝码放在左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点。其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用。已知POH =-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
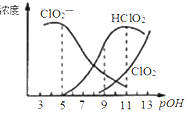
A.亚氯酸钠在碱性条件下较稳定
B.PH=7时,溶液中含氯微粒的浓度大小:c(ClO2—)﹥c(HClO2)﹥c (ClO2)
C.HClO2的电离平衡常数的数值Ka=10-6
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2—) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
(1)Zn2+基态核外电子排布式为
(2)与CNO-互为等电子体的分子、离子化学式分别为 、 (各写一种)
(3)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为 ,某种ZnO晶体的晶胞如图1所示,O2-的配位数为


图1 ZnO晶胞 图2 GaN晶胞
(4)图2是氮化镓的晶胞模型。其中镓原子的杂化方式为 杂化,N、Ga原子之间存在配位键,该配位键中提供电子对的原子是 。氮化镓为立方晶胞,晶胞边长为a pm,若氮化镓的密度为ρg·cm-3,则氮化镓晶胞边长的表达式a= pm(设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是
A.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围:![]() a mol = ne =
a mol = ne = ![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,8g O2含有4NA个电子
B. 1L 0.1mol·L-1的氨水中有0.1NA个NH4+
C. 标准状况下,22.4L四氯化碳含有NA个分子
D. 1molNa被完全氧化生成Na2O2,失去2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
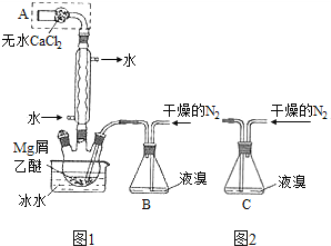
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是__________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
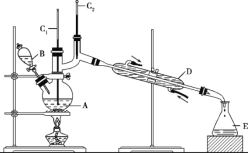
反应物和产物的相关数据列表如下:
沸点/。c | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90 ~ 95。C,在E中收集90。C以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75 ~ 77。C馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_______________________。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________________。
(3)上述装置图中,B仪器的名称是_________________,D仪器的名称是___________________。
(4)分液漏斗使用前必须进行的操作是_____________(填正确答案标号)。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在____________层(填“上”或“下”)
(6)反应温度应保持在90~95。C,其原因是__________________________。
(7)本实验中,正丁醛的产率为___________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL MgCl2、AlCl3的混合溶液中,c(Mg2+)=0.2mol/L、c(Cl)=1.3mol/L,若要使其中的Mg2+全部转化为沉淀而分离出来,至少需要4mol/L的NaOH溶液的体积为( )
A.120mL B.80mL C.40mL D.20mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com