
A、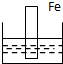 |
B、 |
C、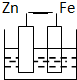 |
D、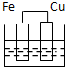 |


科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2] |
| B、已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol?L-1 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH>1 |
| D、室温下,0.1mol?L-1 NaHA溶液的pH=4,则有C(HA-)>C(H+)>C(A2-)>C(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+2HCl=H2↑+ZnCl2 | ||||
| B、CaCO3+2HCl=CO2↑+CaCl2+H2O | ||||
C、MnO2+4HCl(浓)
| ||||
| D、HCl+KOH=KCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏时把温度计插入液面下 |
| B、向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制银镜 |
| C、在试管内加入少量蔗糖溶液,再加3-5mL稀硫酸小心煮沸几分钟后冷却,加新制Cu(OH)2,煮沸,有红色沉淀生成 |
| D、用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
A、
| ||||
| B、K2 | ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去AgI胶体中混有的I-离子--过滤、洗涤、干燥 |
| B、除去苯中含有的少量苯酚--加入NaOH溶液、分液 |
| C、分离CuSO4?5H2O和BaSO4的混合物--溶解、过滤 |
| D、除去乙酸乙酯中混有的乙酸杂质--加入NaOH溶液、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com