

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.X、Y、W的最高价含氧酸酸性顺序:Y>W>X | B.气态氢化物的稳定性:Z>W |
| C.原子半径:Z>W>X>Y | D.X、W形成的化合物XW4属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n) |
| B.SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 |
| C.M层电子数为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等 |
| D.由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

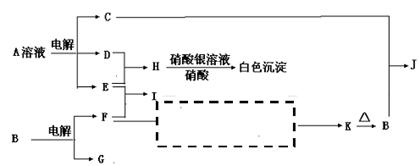
 A+L的化学方程式为: 。
A+L的化学方程式为: 。 。
。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H原子变成He原子属于化学变化,不属于物理变化 |
| B.He原子半径大于H半径 |
| C.在一定条件下质量可转变成能量 |
| D.在遥远的将来(约50亿年后)太阳会“烧尽” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定有碘离子,不能确定是否含有氯离子 | B.一定含有硝酸根离子 |
| C.一定含有碘离子、氯离子、硝酸根离子 | D.不含铁离子和硝酸根离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com