
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
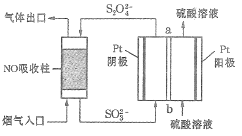
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
【答案】+175.2kJ/mol BC < > 66.7% < 2SO32-+4H++2e-=S2O42-+2H2O 11.2
【解析】
I.(1)则将a+b可得CH4(g)+2H2O(g)CO2(g)+4H2(g) △H;
(2)①起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨,达到平衡时,正、逆反应速率相等,各物质的浓度不变,气体的总物质的量不变,以此判断;
②增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大;升高温度,平衡逆向移动,平衡常数减小;
③起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,结合方程式计算;压强越大、温度越高,反应速率越快;
II.根据图示可知,阴极通入的SO32-发生得电子的还原反应生成S2O42-,结合溶液为酸性书写阴极反应式;写出电解池的总反应,根据通过的氢离子物质的量可知转移电子的物质的量,吸收柱中生成的气体为氮气,然后利用电子守恒计算氮气的物质的量,最后根据V=nVm计算标况下体积。
I.(1)已知a.CH4(g)+H2O(g)CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2kJ/mol
则将a+b,可得CH4(g)+2H2O(g)CO2(g)+4H2(g) △H=(+216.4-41.2)kJ/mol=+175.2kJ/mol;
(2)①A.N2和H2的起始物料比为1:3,且按照1:3反应,则无论是否达到平衡状态,转化率都相等,N2和H2转化率相等不能用于判断是否达到平衡状态,A错误;
B.气体的总质量不变,由于该反应的正反应是气体体积减小的反应,恒压条件下,当反应体系密度保持不变时,说明体积不变,则达到平衡状态,B正确;
C.![]() 保持不变,说明氢气、氨气的浓度不变,反应达到平衡状态,C正确;
保持不变,说明氢气、氨气的浓度不变,反应达到平衡状态,C正确;
D.达平衡时各物质的浓度保持不变,但不一定等于化学计量数之比,![]() 不能确定反应是否达到平衡状态,D错误;
不能确定反应是否达到平衡状态,D错误;
故合理选项是BC;
②由于该反应的正反应是气体体积减小的反应,增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大,由图象可知P1<P2,该反应的正反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,则反应平衡常数:B点>D点;
③起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,设转化N2物质的量为xmol,则
N2(g) +3H2(g) 2NH3(g)
起始:1mol 3mol 0
转化:x mol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则![]() ×100%=50%,解得x=
×100%=50%,解得x=![]() ,则C点H2的转化率为
,则C点H2的转化率为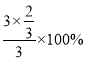 =66.7%,B点的压强、温度都比A点高,压强越大、温度越高,反应速率越大,所以υ(A)<υ(B);
=66.7%,B点的压强、温度都比A点高,压强越大、温度越高,反应速率越大,所以υ(A)<υ(B);
II.根据图示可知,阴极通入的SO32-发生得电子的还原反应生成S2O42-,则阴极反应式为:2SO32-+4H++2e-=S2O42-+2H2O;电解池的阳极水电离出的氢氧根离子放电生成氧气,发生反应为:2H2O-4e-=4H++O2↑,则电解池中总反应为:4SO32-+4H+![]() 2S2O42-+2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子交换膜(ab)的H+为2mol时,转移电子的物质的量为2mol,生成1molS2O42-,图示NO吸收柱中S2O42-失去电子被氧化成SO32-,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=
2S2O42-+2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子交换膜(ab)的H+为2mol时,转移电子的物质的量为2mol,生成1molS2O42-,图示NO吸收柱中S2O42-失去电子被氧化成SO32-,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=![]() =0.5mol,标况下0.5mol氮气的体积为:22.4L/mol×0.5mol=11.2L。
=0.5mol,标况下0.5mol氮气的体积为:22.4L/mol×0.5mol=11.2L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D。回答下列问题:
D。回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则:
①简述检验A气体的方法_________________________________________;
②写出D制备B的离子方程式_________________________________________;
③写出由A生成B的化学方程式_________________________________________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因______________________________;
(2)若A与B反应能生成一种淡黄色固体单质。写出B→C的化学方程式_____________;
(3)若A是金属单质,C是一种淡黄色固体。写出C的电子式________说出C的一种用途_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
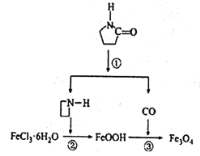
A. 在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:
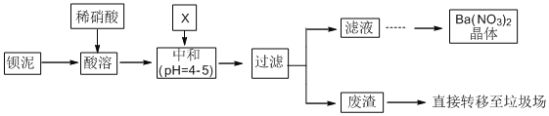
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为__________________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中______(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_________、_________、过滤。
(5)该厂生产的Ba(NO3)2晶体含有少量Cu2+。化学上通过惰性电极电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成。生成该气体的电极反应为______________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为___________;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
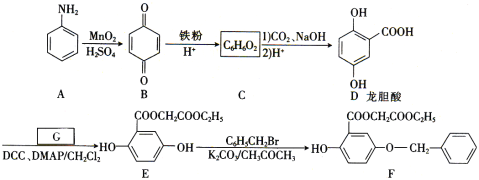
(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: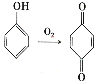 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(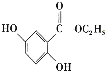 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中HCHO的氧化,其反应如下:HCHO+O2![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A. HCHO含有的官能团为羧基
B. CO2分子是由极性键形成的极性分子
C. HCHO分子中既含σ键又含π键
D. 每生成18 g H2O消耗22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
![]()
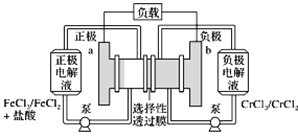
A. 电池放电时,a极的电极反应式为Fe3++3e===Fe
B. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L1
C. 电池充电时,Cl从a极穿过选择性透过膜移向b极
D. 电池充电时,b极的电极反应式为Cr3++e===Cr2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)①和②两种元素的非金属性强弱关系是:①________②(填“>”或“<”)。
(2)③和⑥两种元素形成的化合物中含有的化学键为__________(填“离子键”或“共价键”) 。
(3)元素②和⑤组成的化合物属于_________(填“酸性”“碱性”或“两性”)氧化物。
(4)工业上冶炼元素④所形成的单质,其相关反应的化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com