
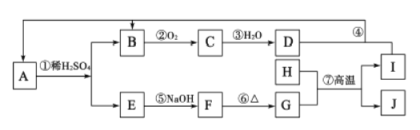
����Ŀ����ͼ������ A~J��һ�������µ�ת����ϵ�����ֲ��P��Ӧ����δ�г���������CΪ����ɫ������H��I�����ֳ����Ľ�������������I�� D��Һ��Ӧ����A��
����д���пհף�
(1)HԪ�������ڱ��е�λ����________��д���ٵ����ӷ�Ӧ����ʽ��_________������E��Һ�������ӵ�����Լ�Ϊ________��
(2)���෴Ӧ������ұ�����۵�Ľ�������MnO2ұ�������̵ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(3)SCR��������������β��ʱ���ڴ����������ð�����C��Ӧ����������Ⱦ�����ʡ�������Ӧ�Ļ�ѧ����ʽΪ__________��
(4)F��NaClO��NaOH��Һ��Ӧ�����Ƶ�һ������ɫ����Ч��ˮ��K2FeO4��ÿ����1molFeO42-ʱת��____________mol���ӡ�
(5)BΪ������Ⱦ�����̿�ۿ��Խ��仹ԭΪ����Ⱦ������X2��
��֪��X2(g)+O2(g)=2XO(g) ��H=+180.6kJ/mol
C(s)+O2(g)=CO2(g) ��H=-393.5kJ/mol
д����̼�ۻ�ԭB���Ȼ�ѧ����ʽ__________��
���𰸡��������ڢ�A�� 3Fe2++NO3-+4H+=3Fe3++NO��+2H2O KSCN��Һ 3��4 8NH3+6NO2![]() 7N2+12H2O 3 C(s)+2NO(g)=CO2(g)+N2(g) ��H=-574.1kJ/mol
7N2+12H2O 3 C(s)+2NO(g)=CO2(g)+N2(g) ��H=-574.1kJ/mol
��C(s)+2XO(g)=CO2(g)+X2(g) ��H=-574.1kJ/mol
��������
��Ӧ��H��I�����ֳ����Ľ���������H��G�ڸ����·�Ӧ����I��J����H��Al��I��Fe��J��Al2O3,G��Fe����������CΪ����ɫ���壻C��B��O2��Ӧ���ɣ���B��NO��C��NO2��B��H2O��Ӧ������D��HNO3������I�� D��Һ��Ӧ����A����A��Fe(NO3)2��E��Fe(NO3)3��E��NaOH��Һ��Ӧ����F��Fe(OH)3��F���ȷֽ����G����G��Fe2O3��
(1)H��Al��AlԪ�������ڱ��е�λ���ǵ������ڢ�A�壬��Ӧ����Fe2+�����������±�NO3-������ΪFe3+�Ĺ��̣����ӷ�Ӧ����ʽ��3Fe2++NO3-+4H+=3Fe3++NO��+2H2O��E�н�����������Fe3+������Fe3+������Լ�ΪKSCN��Һ����������Һ��ΪѪ��ɫ����֤����Fe3+��
(2)���ȷ�Ӧ������ұ�����۵�Ľ���������MnO2ұ�������̣���Ӧ����ʽΪ4Al+3MnO2![]() 3Mn+2Al2O3���ڷ�Ӧ����������MnO2����ԭ����Al���������뻹ԭ�������ʵ���֮��Ϊ3��4��
3Mn+2Al2O3���ڷ�Ӧ����������MnO2����ԭ����Al���������뻹ԭ�������ʵ���֮��Ϊ3��4��
(3)SCR��������������β��ʱ���ڴ����������ð�����NO2��Ӧ����������Ⱦ������N2��ˮ�����ݵ����غ㼰ԭ���غ㣬��֪��Ӧ����ʽΪ8NH3+6NO2![]() 7N2+12H2O��
7N2+12H2O��
(4)F��Fe(OH)3��Fe(OH)3��NaClO��NaOH��Һ��Ӧ�����Ƶ�һ������ɫ����Ч��ˮ��K2FeO4����Fe(OH)3��FeԪ�ػ��ϼ�Ϊ+3�ۣ���K2FeO4��FeԪ�ػ��ϼ�Ϊ+6�ۣ�����ÿ����1molFeO42-ʱת��3mol������
(5)B ��NO�����Ǵ�����Ⱦ�����̿�ۿ��Խ��仹ԭΪ����Ⱦ������N2��
��X2(g)+O2(g)=2XO(g) ��H=+180.6kJ/mol ��C(s)+O2(g)=CO2(g) ��H=-393.5kJ/mol
��-�٣������ɵã�C(s)+2XO(g)=CO2(g)+X2(g) ��H=-574.1kJ/mol����дΪC(s)+2NO(g)=CO2(g)+N2(g) ��H=-574.1kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ijNa2CO3��Һ�м���ϡ���ᣬ��Һ�к�̼�������ʵ�������(��)����ҺpH�仯�IJ��������ͼ��ʾ������˵������ȷ����
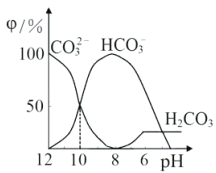
A. pH=7ʱ�� c(Na+)=(Cl�� )+c(HCO3��)+2c(CO32��)
B. pH=8ʱ��c(Na+)=c(C1��)
C. pH=12ʱ�� c(Na+ )>c(OH�� )>c(CO32��)>c(HCO3��)>c(H+)
D. 25��ʱ��CO32��+H2O![]() HCO3��+OH����ˮ��ƽ�ⳣ��Kh=10��10mol��L��1
HCO3��+OH����ˮ��ƽ�ⳣ��Kh=10��10mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ָ��������һ���ܹ������������
A. ͨ��SO2������Na+��Ca2+��Cl-��ClO-
B. ������Һ����Mg2+��Fe3+��SO42-��Cl-
C. 0.1mol/L��������Һ����K����Ba2����Cl-��HCO3-
D. ![]() mol/L����Һ����NH4+��Cl-��Fe2+��I-
mol/L����Һ����NH4+��Cl-��Fe2+��I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���¢�3.36LNH3��1.204��1023��CH4��18gH2O��0.4molHCl��
a.����ɴ�С��˳��_____������ţ���ͬ����
b.��ԭ�Ӹ����ɴ�С��˳��___��
��2��18.6gNa2X����0.6molNa������X2-��Ħ������Ϊ__��
��3����agij�����к��еķ�����Ϊb����cg�������ڱ���������(��NAΪ�����ӵ�������ֵ)____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ�������Դ��չ����̼����������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H1= -1275.6 kJ��mol-1����2CO(g)+O2(g)=2CO2(g) ��H2=-566.0 kJ��mol-1����H2O(g)=H2O(l) ��H3= -44.0 kJ��mol-1��
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_______________��
��2����ҵ��һ��ɲ������·�Ӧ���ϳɼ״���2H2(g)+CO(g)![]() CH3OH(g) ��H= -90.8kJmol-1��
CH3OH(g) ��H= -90.8kJmol-1��
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c(CO)=0.2mol/L����CO��ת����Ϊ____����CH3OH��ʾ�ù��̵ķ�Ӧ����v(CH3OH)=______��
��Ҫ��߷�Ӧ2H2(g)+CO(g)CH3OH(g)��CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_______��
a������ b��������� c������CO��Ũ�� d������H2 e������������� f��������״�
��3����ͼ��һ����ѧ���̵�ʾ��ͼ��

��ͼ�м׳���________װ��(��������������ԭ�����)������OH������________��(����CH3OH������O2��)��
��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ____________________________��
���ҳ����ܷ�Ӧ�����ӷ���ʽΪ______________________________________��
�ܵ��ҳ���B(Ag)������������5.40gʱ����ʱ����ij�缫����1.60gij����������е�ij����Һ������________(�����)��
A��MgSO4 B��CuSO4 C��NaCl D��Al(NO3)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g) ��H=-197kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2molSO2��lmolO2��(��) lmolSO2��0.5molO2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3(g) ��H=-197kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��)2molSO2��lmolO2��(��) lmolSO2��0.5molO2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
A. ������ѹǿP��P��=P��>2P��
B. SO3������m��m��=m��>2m��
C. c(SO2)��c(O2)֮�� k��k��=k��>k��
D. ��Ӧ�ų���������������ֵQ��Q��=Q��>2Q��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��������ȷ����

A. ͼ�ٿɱ�ʾ������ͨ�������Һ��������������Һ�����Եı仯
B. ����ͼ�ڿ��жϿ��淴ӦA2(g)+3B2(g)![]() 2AB3(g)����H��0
2AB3(g)����H��0
C. ͼ�۱�ʾ���������pH�������������Һ�ֱ���������п�۷�����Ӧ�������������(V)��ʱ�ı仯��ʾ��ͼ
D. ͼ�ܿɱ�ʾѹǿ�Կ��淴ӦA(g)+B(g)![]() 2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ʵ����������Ӧ������ȷ����
ѡ�� | ʵ����ʵ | ���� |
A | ����������ͬ��Na2S2O3��H2SO4��Ӧʱc(Na2S2O3)Խ������S������ʱ��Խ�� | ��������������ʱ������Ӧ��Ũ�ȣ���ѧ��Ӧ���ʼӿ� |
B | �ڻ�ѧ��Ӧǰ�����������ͻ�ѧ���ʶ�û�з����ı� | ����һ�������뻯ѧ��Ӧ |
C | ���ʵ���Ũ����ͬ������ʹ���ֱ���������ġ���״��ͬ��п����Ӧ | ��Ӧ��ʼʱ������ͬ |
D | ���ݻ��ɱ���ܱ������з�����ӦH2(g)��I2(g) | ����Ӧ���ʼӿ죬�淴Ӧ���ʲ��� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com