
【题目】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1,②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1,③H2O(g)=H2O(l) ΔH3= -44.0 kJ·mol-1,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______________。
(2)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
(3)如图是一个化学过程的示意图:

①图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式: ____________________________。
③乙池中总反应的离子方程式为______________________________________。
④当乙池中B(Ag)极的质量增加5.40g时,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.Al(NO3)3
【答案】CH3OH(1)+O2(g)=CO(g)+2H2O(1) △H= -442.8 kJmol-1 80% 0.08mol/(L·min) df 原电池 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O![]() 4Ag+O2↑+4H+ B
4Ag+O2↑+4H+ B
【解析】
(1)甲醇不完全燃烧生成CO和液态水,其反应方程式为CH3OH+O2→CO+2H2O,根据盖斯定律,![]() ,推出CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
,推出CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=![]() = -442.8kJ·mol-1;
= -442.8kJ·mol-1;
(2)①达到平衡时,n(CO)=0.2mol·L-1×2L=0.4mol,
2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
起始: 6 2 0
变化:3.2 1.6 1.6
平衡:2.8 0.4 1.6
CO的转化率为![]() ×100%=80%;根据化学反应速率的表达式,v(CH3OH)=
×100%=80%;根据化学反应速率的表达式,v(CH3OH)=![]() =0.08mol/(L·min);
=0.08mol/(L·min);
②a、该反应为放热反应,升温,平衡向逆反应方向移动,即CO转化率降低,故a不符合题意;
b、加入催化剂,使用催化剂,对化学平衡移动无影响,故b不符合题意;
c、增加CO的浓度,虽然平衡向正反应方向移动,但CO的转化率降低,故c不符合题意;
d、加入H2,平衡向正反应方向进行,CO的转化率增大,故d符合题意;
e、体积不变,加入惰性气体,组分浓度不变,化学平衡不移动,CO转化率不变,故e不符合题意;
f、分离出甲醇,减小生成物的浓度,平衡向正反应方向移动,CO的转化率增大,故f符合题意;
答案选df;
(3)①根据甲池的装置图,甲池装置图为原电池,通CH3OH一极为负极,通氧气的一极为正极,根据原电池工作原理,OH-向负极移动,即向通CH3OH一极移动;
②甲池是燃料电池,相当于CH3OH在氧气燃烧,电解质为KOH溶液,C元素最终以CO32-形式存在,负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;
③A电极接电池正极,A电极为阳极,电极反应式为2H2O-4e-=O2↑+4H+, B电极为阴极,电极反应式为Ag++e-=Ag,总反应离子方程式为4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
④乙池中B电极反应式为Ag++e-=Ag,B极增加5.40g,生成Ag的物质的量为![]() =0.05mol,电路中转移电子物质的量为0.05mol,丙池某电极上析出金属,该电极为阴极,即D电极,乙池和丙池为串联电路,丙池通过的电子物质的量也为0.05mol,
=0.05mol,电路中转移电子物质的量为0.05mol,丙池某电极上析出金属,该电极为阴极,即D电极,乙池和丙池为串联电路,丙池通过的电子物质的量也为0.05mol,
A、硫酸镁中Mg位于H元素的前面,即阴极上不析出金属,故A不符题意;
B、电解CuSO4溶液时,D电极反应式为Cu2++2e-=Cu,转移电子0.05mol,析出铜的质量为1.60g,故B符合题意;
C、电解NaCl水溶液,没有金属析出,故C不符合题意;
D、电解Al(NO3)3水溶液,没有金属析出,故D不符合题意;
答案选B。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)③、④、⑤、⑥简单离子半径由小到大的顺序为_____________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

(a)X溶液与Y溶液反应的离子方程式为_________,
(b)N→⑥的单质的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
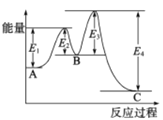
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
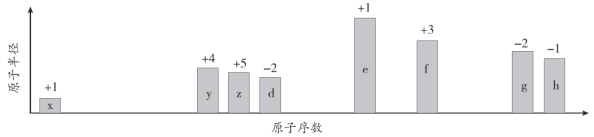
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)______>_______;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>____。
(3)画出x2d2的电子式:____________________;
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)写出用惰性电极电解eh溶液的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物 A~J在一定条件下的转化关系(部分产物及反应条件未列出)。其中C为红棕色气体;H和I是两种常见的金属单质;过量I与 D溶液反应生成A。
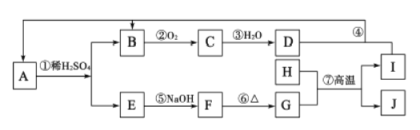
请填写下列空白:
(1)H元素在周期表中的位置是________;写出①的离子反应方程式:_________;检验E溶液中阳离子的最佳试剂为________。
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为__________。
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为__________。
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移____________mol电子。
(5)B为大气污染物,利用炭粉可以将其还原为无污染的物质X2。
已知:X2(g)+O2(g)=2XO(g) △H=+180.6kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出用碳粉还原B的热化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素及其化合物在物质制备、生产生活中发挥着重要作用。
I.CO2与NH3合成尿素的反应如下:CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) △H=akJ/mol
[CO(NH2)2](s)+H2O(g) △H=akJ/mol
曲线表示不同温度、不同压强下,CO2的平衡转化率与温度的关系,请回答下列问题:

(1)a__________0,P1__________P2(填“>”、“<”或“=”)。
(2)t℃时,向容积为2L的密闭容器中充入3molNH3和1molCO2,实现M点的平衡,则
①平衡时容器内压强为开始时的____________倍,t℃时的化学平衡常数为__________。
②若保持条件不变,再向该容器中充入1molNH3和1molCO2,NH3的转化率将________(填“增大”、“减小”或“不变”)。
II.硫及其化合物在生产生活中应用广泛,回答下列问题。
(1)铁铵矾是一种化学物质,分子式为NH4Fe(SO4)212H2O,其溶于水后,溶液中离子浓度大小关系为________________________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液向其中加入 BaCl2溶液,当CO32-开始沉淀时,溶液中![]() 为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
(3)恒温恒容密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
a.体系压强保持不变 b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变 d.每消耗1molSO3的同时生成0.5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
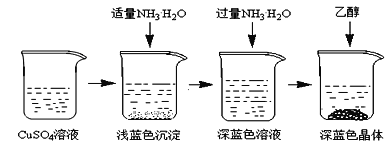
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
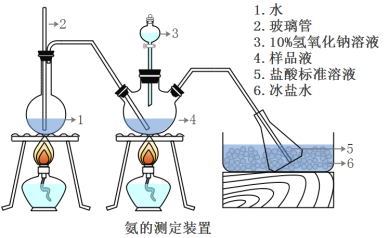
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
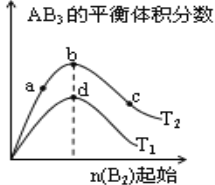
A. 若T2>T1,则正反应一定是放热反应
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2>T1,达到平衡时b、d点的反应速率为vd> vb
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com