
����Ŀ���ǽ���Ԫ�ؼ��仯�����������Ʊ������������з�������Ҫ���á�
I.CO2��NH3�ϳ����صķ�Ӧ���£�CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) ��H=akJ/mol
[CO(NH2)2](s)+H2O(g) ��H=akJ/mol
���߱�ʾ��ͬ�¶ȡ���ͬѹǿ�£�CO2��ƽ��ת�������¶ȵĹ�ϵ����ش��������⣺

(1)a__________0��P1__________P2������������������������������
(2)t��ʱ�����ݻ�Ϊ2L���ܱ������г���3molNH3��1molCO2��ʵ��M���ƽ�⣬��
��ƽ��ʱ������ѹǿΪ��ʼʱ��____________����t��ʱ�Ļ�ѧƽ�ⳣ��Ϊ__________��
���������������䣬����������г���1molNH3��1molCO2��NH3��ת���ʽ�________������������������С����������������
II.���仯����������������Ӧ�ù㷺���ش��������⡣
(1)��立���һ�ֻ�ѧ���ʣ�����ʽΪNH4Fe(SO4)212H2O��������ˮ����Һ������Ũ�ȴ�С��ϵΪ________________________________��
(2)��֪ij��Һ�к���CO32-��SO42-�����ӣ�ȡһ�����ĸ���Һ�����м��� BaCl2��Һ����CO32-��ʼ����ʱ����Һ��![]() Ϊ____________��(��֪��Ksp(BaSO4)=1.0��10-10��Ksp(BaSO4)=2.5��10-9��
Ϊ____________��(��֪��Ksp(BaSO4)=1.0��10-10��Ksp(BaSO4)=2.5��10-9��
(3)���º����ܱ������з������·�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-197kJ/mol��������˵����Ӧ�ﵽƽ��״̬����___________��
2SO3(g) ��H=-197kJ/mol��������˵����Ӧ�ﵽƽ��״̬����___________��
a.��ϵѹǿ���ֲ��� b.���������ܶȱ��ֲ���
c.SO3��O2������ȱ��ֲ��� d.ÿ����1molSO3��ͬʱ����0.5molO2
���𰸡��� �� 0.75 1 ���� c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-) 25 a c
��������
I.(1)�����¶ȡ�ѹǿ��ƽ���ƶ���Ӱ������жϣ�
(2) �������ں����ܱ���������������ʵ����ıȵ���ѹǿ�ȼ��㣬����ƽ�ⳣ������ʽ���㣻
�ڸ������μ����NH3��CO2�ı����������ʵ�ƽ��ת���ʱ仯��
II.(1)���������غ㡢�ε�ˮ����ɱȽϣ�
(2)�����ܶȻ��������㣻
(3)����Ӧ����ƽ��״̬ʱ���������ʵĺ������䣬���ʵ���Ũ�Ȳ��䣬��������ѹǿ���䡣
I.(1)����ͼ���֪����������������ʱ�������¶ȣ�CO2ת���ʽ��ͣ�˵��ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ����ƶ����淴ӦΪ���ȷ�Ӧ����÷�Ӧ������ӦΪ���ȷ�Ӧ��������H=a<0���÷�Ӧ������ӦΪ���������С�ķ�Ӧ����������������ʱ������ѹǿ��ƽ�������ƶ���CO2ת������������P1>P2��
(2)�� t��ʱ�����ݻ�Ϊ2L���ܱ������г���3molNH3��1molCO2��
������Ӧ�� CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) M��ʵ�ֻ�ѧƽ��
[CO(NH2)2](s)+H2O(g) M��ʵ�ֻ�ѧƽ��
c(ʼ)mol/L 0.5 1.5 0
c(��)mol/L 0.25 0.5 0.25
c(ƽ)mol/L 0.25 1.0 0.25
K=![]() ��ƽ��ʱ��������ʵ���n=0.25��2+1.0��2+0.25��2=3����ʼʱ��������ʵ�����3+1=4mol������������˵��ѹǿ�ȵ���������������ʵ����ıȣ�����
��ƽ��ʱ��������ʵ���n=0.25��2+1.0��2+0.25��2=3����ʼʱ��������ʵ�����3+1=4mol������������˵��ѹǿ�ȵ���������������ʵ����ıȣ�����![]()
���������������䣬����������г���1molNH3��1molCO2��CO2�� NH3����ı�����ԭ�����൱��������CO2��Ũ�ȣ�����NH3��ת���ʽ�������
��立���һ�ֻ�ѧ���ʣ�����ʽΪNH4Fe(SO4)212H2O
II.(1) ��立�����ˮ���뷽��ʽΪNH4Fe(SO4)212H2O=NH4++Fe3++2SO42-������Fe3+��NH4+������ˮ�ⷴӦ������ˮ���������OH-�����Ե���ˮ��ƽ��ʱ����Һ�����ԣ�c(H+)>c(OH-)������Fe(OH)3�ĵ���ƽ�ⳣ����NH3H2OС��Fe3+ˮ��̶ȱ�NH4+������c(NH4+)>c(Fe3+)���ε������������Ũ�ȴ���ˮ�ĵ���̶ȣ�����Һ������Ũ�ȴ�С��ϵΪc(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-)��
(2)����CO32-��SO42-���ӵĸ���Һ�����м��� BaCl2��Һ����CO32-��ʼ����ʱ����Һ��![]() =
=![]() =25��
=25��
(3) a.�ں����ܱ������з����ĸ÷�Ӧ������������ȵķ�Ӧ������ϵѹǿ���ֲ��䣬����������ʵ������䣬��Ӧ�ﵽƽ�⣬a��ȷ��
b.��Ӧ����ﶼ�����壬�κ�������ܶȶ����䣬���Բ���ȷ����Ӧ�Ƿ�ﵽƽ�⣬b����
c. SO3��O2һ���������һ���Ƿ�Ӧ������ߵ�����ȱ��ֲ��䣬˵����Ӧ�ﵽƽ��״̬��c��ȷ��
d.�������ʷ�Ӧʱ�仯�����ʵ�����ϵ��֪�����κ������ÿ����1molSO3��ͬʱ����0.5molO2����˲��ܾݴ��жϷ�Ӧ����ƽ��״̬��d����
�ʺ���ѡ����ac��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������.����ʳƷ���Ӽ���˵����ȷ���ǣ� ��
A.ʳ�β�����������
B.ʳƷ���Ӽ����ɲ���ʳƷ��Ӫ���ɷ�
C.���ܲ��ؿ�����ɫ��
D.��ֻ������ζ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������裨Si3N4����һ�������մɲ��ϣ���������ʯӢ�뽹̿�ڸ����µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪK=___________________��
(2)��ͬ�¶���SiO2��ƽ��ת������ʱ��ı仯��ͼ��ʾ����÷�ӦΪ___________��Ӧ�������������������������������¶ȣ���ƽ�ⳣ��ֵ��___________�������������� ��С����������������
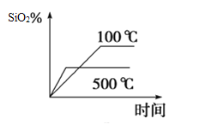
(3)��֪��Ӧ�ﵽƽ��ʱ��CO����������Ϊv (CO) =18 mol��L-1��min-1����N2��������Ϊv(N2)=
____________mol��L-1��min-1��
(4)��Ӧ�ﵽƽ��ʱ��ѹ�������������ƽ�⽫��________��Ӧ�����ƶ�����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ�������Դ��չ����̼����������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H1= -1275.6 kJ��mol-1����2CO(g)+O2(g)=2CO2(g) ��H2=-566.0 kJ��mol-1����H2O(g)=H2O(l) ��H3= -44.0 kJ��mol-1��
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_______________��
��2����ҵ��һ��ɲ������·�Ӧ���ϳɼ״���2H2(g)+CO(g)![]() CH3OH(g) ��H= -90.8kJmol-1��
CH3OH(g) ��H= -90.8kJmol-1��
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c(CO)=0.2mol/L����CO��ת����Ϊ____����CH3OH��ʾ�ù��̵ķ�Ӧ����v(CH3OH)=______��
��Ҫ��߷�Ӧ2H2(g)+CO(g)CH3OH(g)��CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_______��
a������ b��������� c������CO��Ũ�� d������H2 e������������� f��������״�
��3����ͼ��һ����ѧ���̵�ʾ��ͼ��

��ͼ�м׳���________װ��(��������������ԭ�����)������OH������________��(����CH3OH������O2��)��
��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ____________________________��
���ҳ����ܷ�Ӧ�����ӷ���ʽΪ______________________________________��
�ܵ��ҳ���B(Ag)������������5.40gʱ����ʱ����ij�缫����1.60gij����������е�ij����Һ������________(�����)��
A��MgSO4 B��CuSO4 C��NaCl D��Al(NO3)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
�ٹ�ҵ�ϳɰ�N2(g)+3H2(g)![]() 2NH3(g) ��H<0����Ӧ����ѡ�����
2NH3(g) ��H<0����Ӧ����ѡ�����
��ʵ���ҿ������ű���ʳ��ˮ�ķ����ռ�����
�����Ṥҵ��2SO2+O2![]() 2SO3������O2��Ũ�����������SO2��ת����
2SO3������O2��Ũ�����������SO2��ת����
�ܶ�CO(g)+NO2(g)![]() CO2(g) + NO(g)ƽ����ϵ����ѹǿ��ʹ��ɫ����
CO2(g) + NO(g)ƽ����ϵ����ѹǿ��ʹ��ɫ����
A. �ڢ� B. �ڢ� C. �٢� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��������ȷ����

A. ͼ�ٿɱ�ʾ������ͨ�������Һ��������������Һ�����Եı仯
B. ����ͼ�ڿ��жϿ��淴ӦA2(g)+3B2(g)![]() 2AB3(g)����H��0
2AB3(g)����H��0
C. ͼ�۱�ʾ���������pH�������������Һ�ֱ���������п�۷�����Ӧ�������������(V)��ʱ�ı仯��ʾ��ͼ
D. ͼ�ܿɱ�ʾѹǿ�Կ��淴ӦA(g)+B(g)![]() 2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HC1O |
����ƽ�ⳣ�� | 1.7��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 |
��ش��������⣺
��1��CH3COOH��H2CO3��HC1O��������ǿ������˳��Ϊ______________________��
��2��������0.1 mol��L-1��CH3COOH��Һ�������{�¶ȣ�����4�ֱ���ʽ�������������______��
A��c(H+) B��c(H+)/c(CH3COOH) C�� c(H+)��c(OH-) D��c(CH3COO��)��c(H+)/c(CH3COOH)
��3��ȡ0.10mol CH3COOH �������ᣩ��������ʵ�飬����䵼����������ˮ���仯��ͼ��ʾ���Ƚ�a��b���������ʣ��>����<����=������

n(H+)��a_____b��c(CH3COO-)��a_____b����ȫ�к�ʱ����NaOH�����ʵ�����a_____b��
��4��H+Ũ����ͬ�������������ҺA(���ᣩ��B(CH3COOH)�քe��п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ����__________����д��ţ�
�ٷ�Ӧ����Ҫ��ʱ��B>A �ڿ�ʼ��Ӧʱ������A>B
�۲μӷ�Ӧ��п�����ʵ���A=B ��A����пʣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�ؼ��仯����㷺��������Ȼ���С��ش��������⣺
(1)����(COCl2)��һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;�������ķ������幹��Ϊ______________��������Ԫ�صĵ縺����С�����˳��Ϊ______________����COCl2��Ϊ�ȵ�����ķ��Ӻ�����(��дһ��)__________��
(2)�ճ������У�����������ɼ��⣬����ƣ��Դ�ԭ�ӽṹ�ǶȽ�����һ����____________________________��
(3)���־�̬��������ͷǾ�̬����������ɿ��Ŀ�ѧ������_____________��
(4)һ��ͭ���廯�ᄃ���ṹ��ͼ��ʾ������ͼ�е�Cuȥ�����ٰ����е�Br����Cu���õ�����ͭ�ľ����ṹ������ͭ�Ķѻ���ʽΪ___________��ijͬѧ����̬ͭԭ�Ӽ۵��Ӵ����дΪ3d94s2��Υ���˺�������Ų������е�______��

(5)���й�������ͭ���廯�ᄃ���ṹ˵����ȷ����_________(ѡ����ĸ���)��
A���û�����Ļ�ѧʽΪCuBr2
B��ͭ����λ��Ϊ8
C����ÿ��Br���ڵ�Br��12��
D����ͼ��P���Q���ԭ�����������ȷ��R���ԭ���������Ϊ(1/4,1/4,1/4)
(6)��ͼ��P���R���ԭ�Ӻ˼��Ϊa cm��NAΪ����٤��������ֵ����þ����ܶ�Ϊ______g/cm3��(�г�����ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��������Ӧ��ʵ��������ǣ� ��
A. ��������Һ�в��ϼ�ˮ 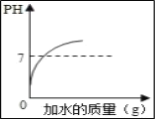
B. һ������ϡ������п����Ӧ 
C. ���ȶ������̺�����صĻ���� 
D. ��ϡH2SO4�еμ�BaCl2��Һ 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com