
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升髙温度,上述4种表达式的数据增大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):

n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
【答案】CH3COOH>H2CO3>HC1O ABCD < > = ③④
【解析】
(1)酸电离平衡常数越大,酸电离程度越大,其酸性越强;
(2)由于弱电解质的电离过程是吸热过程,若该溶液升髙温度促进弱电解质电离平衡正向进行;
(3)醋酸为弱酸,加水促进电离;溶液的导电能力越强,溶液中的离子浓度越大;
(4)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余.
(1)酸的电离平衡常数越大,该酸电离程度越大,其酸性越强,根据表中数据知,酸的电离程度大小顺序是CH3COOH>H2CO3>HClO>HCO3-,所以酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-;
(2)若该溶液升髙温度,促进CH3COOH、H2O电离平衡正向进行,溶液中氢离子浓度、醋酸根离子浓度增大,所以A.氢离子浓度增大;B.c(H+)/c(CH3COOH)比值增大;C.溶液中c(H+)·c(OH-)之积为水的离子积,升温促进水电离,离子积常数增大;D.c(CH3COO-)c(H+)/c(CH3COOH)为平衡常数表达式升温促进电离平衡常数增大;
上述4种表达式的数据增大的是ABCD。
(3)醋酸为弱酸,加水促进电离,则n(H+):a<b,
溶液的导电能力越强,溶液中的离子浓度越大,则c(CH3COO-):a>b,
溶液稀释前后溶质的物质的量不变,则中和时消耗的氢氧化钠的物质的量相等;
(4)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于反应过程中醋酸溶液中氢离子浓度大于盐酸溶液中氢离子浓度,则醋酸溶液反应较快,所以反应所需的时间A>B;故①错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故②错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故③正确;
④醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故④正确;
故选③④;


科目:高中化学 来源: 题型:
【题目】食品安全备受社会关注。下列做法符合食品安全要求的是( )
A.在食用猪血中加甲醛溶液
B.在奶粉中添加三聚氰胺以提高蛋白质含量
C.在焙制面包时添加小苏打
D.在玉米馒头中添加合成色素柠檬黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
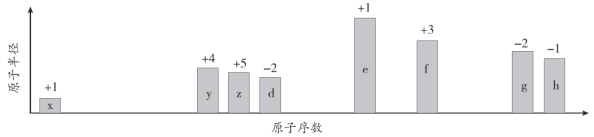
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)______>_______;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>____。
(3)画出x2d2的电子式:____________________;
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)写出用惰性电极电解eh溶液的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素及其化合物在物质制备、生产生活中发挥着重要作用。
I.CO2与NH3合成尿素的反应如下:CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) △H=akJ/mol
[CO(NH2)2](s)+H2O(g) △H=akJ/mol
曲线表示不同温度、不同压强下,CO2的平衡转化率与温度的关系,请回答下列问题:

(1)a__________0,P1__________P2(填“>”、“<”或“=”)。
(2)t℃时,向容积为2L的密闭容器中充入3molNH3和1molCO2,实现M点的平衡,则
①平衡时容器内压强为开始时的____________倍,t℃时的化学平衡常数为__________。
②若保持条件不变,再向该容器中充入1molNH3和1molCO2,NH3的转化率将________(填“增大”、“减小”或“不变”)。
II.硫及其化合物在生产生活中应用广泛,回答下列问题。
(1)铁铵矾是一种化学物质,分子式为NH4Fe(SO4)212H2O,其溶于水后,溶液中离子浓度大小关系为________________________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液向其中加入 BaCl2溶液,当CO32-开始沉淀时,溶液中![]() 为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
(3)恒温恒容密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
a.体系压强保持不变 b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变 d.每消耗1molSO3的同时生成0.5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() ,下列有关推断正确的是
,下列有关推断正确的是
A. 这五种元素均为主族元素
B. 根据该名称,周期表118种元素中非金属元素共有24种
C. Nh的最高价氧化物是一种典型的两性氧化物
D. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
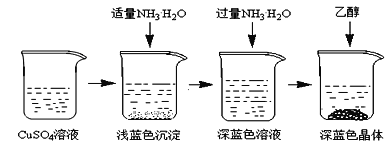
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
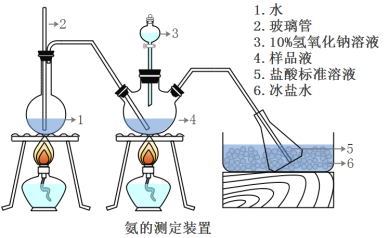
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1molL-1的A、B溶液各10mL ④0.5molL-1的A、B溶液各50mL
四者反应速率的大小关系是
A. ②>①>④>③ B. ④>③>②>①
C. ①>②>④>③ D. ①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸的过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=98.3 kJ·mol1
2SO3(g) ΔH=98.3 kJ·mol1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol1
SO3(g) ΔH=+98.3 kJ·mol1
D. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=49.2 kJ·mol1
SO3(g) ΔH=49.2 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com