
【题目】工业生产硫酸的过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=98.3 kJ·mol1
2SO3(g) ΔH=98.3 kJ·mol1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol1
SO3(g) ΔH=+98.3 kJ·mol1
D. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=49.2 kJ·mol1
SO3(g) ΔH=49.2 kJ·mol1
【答案】A
【解析】
SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应.现将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol.反应是可逆反应,发生反应的二氧化硫为1mol,放热为98.3KJ,所以依据反应放出的热量,结合热化学方程式的书写方法来解答,注意标注物质的聚集状态。
将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol,说明反应是可逆反应,不能进行彻底,实际发生反应的二氧化硫为1mol,1mol二氧化硫全部反应放热98.3KJ,热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1或SO2(g)+1/2O2(g)
2SO3(g) ΔH=196.6 kJ·mol1或SO2(g)+1/2O2(g)![]() SO3(g)△H=-98.3 kJ·mol1。
SO3(g)△H=-98.3 kJ·mol1。
A项、热化学方程式符合题意,故A正确;
B项、热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;
C项、反应是放热反应,不是吸热反应,△H=-98.3 kJ·mol1,故C错误;
D项、热化学方程式中反应热和对应二氧化硫的量不符合,故D错误。
故选A。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可以由石英与焦炭在高温下的氮气流中,通过以下反应制得:3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)该反应的平衡常数表达式为K=___________________;
(2)不同温度下SiO2的平衡转化率随时间的变化如图所示,则该反应为___________反应(填“吸热”或“放热”);升高温度,其平衡常数值将___________(填“增大”“ 减小”或“不变”);
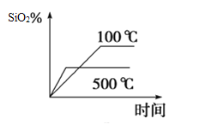
(3)已知反应达到平衡时,CO的生成速率为v (CO) =18 mol·L-1·min-1,则N2消耗速率为v(N2)=
____________mol·L-1·min-1。
(4)反应达到平衡时,压缩容器的体积,平衡将向________反应方向移动(填“正”或“逆”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升髙温度,上述4种表达式的数据增大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):

n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素及其化合物广泛存在于自然界中。回答下列问题:
(1)光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气的分子立体构型为______________,其三种元素的电负性由小到大的顺序为______________。与COCl2互为等电子体的分子和离子(各写一种)__________。
(2)日常生活中,看到的许多可见光,如霓虹灯,试从原子结构角度解释这一现象?____________________________。
(3)区分晶态二氧化硅和非晶态二氧化硅最可靠的科学方法是_____________。
(4)一种铜的溴化物晶胞结构如图所示,若将图中的Cu去掉,再把所有的Br换成Cu,得到晶体铜的晶胞结构,则晶体铜的堆积方式为___________,某同学将基态铜原子价电子错误的写为3d94s2,违背了核外电子排布规律中的______。

(5)下列关于上述铜的溴化物晶胞结构说法正确的是_________(选填字母序号)。
A.该化合物的化学式为CuBr2
B.铜的配位数为8
C.与每个Br紧邻的Br有12个
D.由图中P点和Q点的原子坐标参数,确定R点的原子坐标参数为(1/4,1/4,1/4)
(6)若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为______g/cm3。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,能说明下列反应:C(s)+CO2(g) ![]() 2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
A. ①③④⑤⑦ B. ①②③④⑦
C. ②③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为_____________。E的分子式为_______________。
的官能团名称为_____________。E的分子式为_______________。
(2)B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:_________________。
(3)D→E的反应历程如下:

写出反应Ⅱ、Ⅲ的反应类型:Ⅱ_____________、Ⅲ_____________
(4)写出满足下列条件的A的所有同分异构体的结构简式___________________。
a.能与新制氢氧化铜悬浊液反应产生砖红色沉淀
b.常温下能与Na2CO3反应并释放出气体
(5)请写出以CH2=CH2为主要原料(无机试剂任用)制备OHC—CHO(乙二醛)的合成路线流程图(须注明反应条件)_______。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与所对应的实验相符的是( )
A. 向硫酸溶液中不断加水 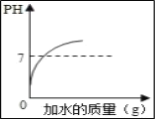
B. 一定量的稀硫酸与锌粒反应 
C. 加热二氧化锰和氯酸钾的混合物 
D. 向稀H2SO4中滴加BaCl2溶液 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制1mol/L的NaOH溶液240mL,
(1)实验操作中用天平称量___gNaOH固体;
(2)容量瓶在使用前的操作是___
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是___。
①称量氢氧化钠固体的时间过长。 ②容量瓶用蒸馏水洗涤后残留有少量的水。
③溶液未冷却即转入容量瓶。 ④在转移氢氧化钠溶液后未洗涤烧杯。
⑤定容时俯视刻度线。⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。
(4)取配制的1mol/L的NaOH溶液10mL,再稀释成100mL,再从中取出10mL,这10mL溶液的物质的量浓度为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com