
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
【答案】C
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+。
A项、a电极为该电池的负极,负极反应生成氢离子,为维持溶液呈电中性,咸水中阴离子Cl-移向负极室左室,则离子交换膜I是氯离子交换膜,故A错误;
B项、电解质溶液中阴离子Cl-移向负极室左室,a电极附近溶液的氯离子浓度增大,b电极消耗氢离子,溶液的pH增大,故B错误;
C项、a电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故C正确;
D项、放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】两种烃组成的混合烃总物质的量与该混合烃充分燃烧后所得气体产物(二氧化碳和水蒸气)物质的量变化关系如图所示。以下对混合烃组成的判断中,正确的是( )
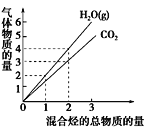
A. 一定有乙烯
B. 一定有甲烷
C. 一定有丙烷
D. 一定没有C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:________________________。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________。
(3)钠在二氧化碳中燃烧的化学方程式为______________________________。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能证明碳的非金属性比硅强的是
Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3 ②SiO2+2C![]() Si+2CO↑
Si+2CO↑
③Na2CO3+SiO2![]() Na2SiO3+CO2↑ ④CH4比SiH4稳定
Na2SiO3+CO2↑ ④CH4比SiH4稳定
A. ①④B. ①②④C. ②④D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法不正确的是
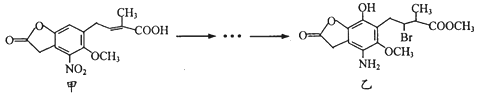
A. 甲的分子式为C14H11NO7
B. 甲和乙所含官能团均为5种
C. 可用NaHCO3溶液鉴别化合物甲和乙
D. 甲能与酸性高锰酸钾溶液反应,乙能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物V: 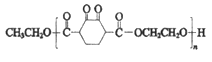 是人造棉的主要成分之一,合成路线如下:
是人造棉的主要成分之一,合成路线如下:
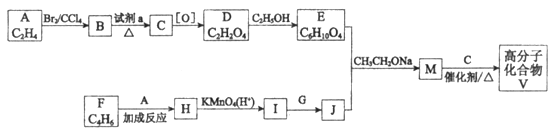
已知:
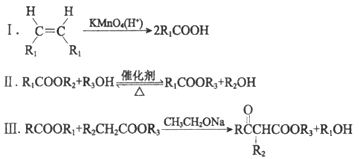
(R、R1、R2、R3表示烃基)
(1)试剂a是____________________________。
(2)F与A以物质的量之比1:1发生反应生成六元环状化合物H,H的结构简式是________________。
(3)I的结构简式是____________。
(4)G中所含官能团是________________;M的结构简式是____________。
(5)M与C反应生成V的化学方程式为____________。
(6)E的同分异构体N也可以和J反应生成M,N可能的结构简式为____________(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
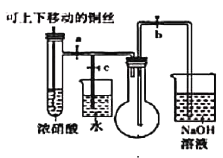
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃ | A | B | C | D |
沸水浴 | 红棕色 | 红棕色 | 红棕色 | 红棕色 |
80-70 | 红棕色 | 红棕色 | 红棕色 | 无色 |
50-40 | 红棕色 | 仅液面上红棕色 | 无色 | 无色 |
20-10 | 仅液面上红棕色 | 无色 | 无色 | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在水溶液中大量共存的是
A.Na+、Ag+、NO3-、CO32-B.Fe2+、H+、SO42-、NO3-
C.Al3+、K+、SO42-、OH-D.Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com