
【题目】下列各组离子中,能在水溶液中大量共存的是
A.Na+、Ag+、NO3-、CO32-B.Fe2+、H+、SO42-、NO3-
C.Al3+、K+、SO42-、OH-D.Na+、Mg2+、Cl-、SO42-
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:NaBr溶液、NaI溶液、新制的氯水
(1)写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲_______ 乙_______ | 离子方程式 甲__________ 乙__________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
(2)[评价]甲同学设计的实验方案的合理性是_____(填字母)。
A.非常合理 B.部分合理 C.完全不合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
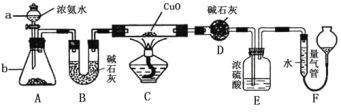
(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g) ![]() 2C(g)是吸热反应
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l) ,反应一段时间后测得c(AsO43-)为a mol·L-1。下列说法能判断反应达到平衡状态的是
AsO43-(aq)+2I-(aq)+H2O(l) ,反应一段时间后测得c(AsO43-)为a mol·L-1。下列说法能判断反应达到平衡状态的是
A. c(I) = 2a mol·L-1B. v(I-) = 2v(AsO33-)
C. c(AsO43-)/c(I)不再变化D. 溶液的pH不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2+不稳定,极易被氧气氧化,不与锌反应。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示。制备过程中发生的相关反应如下所示:
Zn+2HCl===ZnCl2+H2↑
Zn+2CrCl3===2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O(晶体)
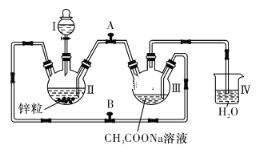
试回答下列问题:
(1)本实验中配制溶液所用的蒸馏水需事先煮沸,原因是__________。
(2)往仪器Ⅱ中加盐酸和CrCl3溶液的顺序最好是__________________________,理由是____________。
(3)为使生成的CrCl2溶液与CH3COONa溶液混合,应关闭阀门____(填“A”或“B”,下同),打开阀门_____。
(4)本实验中锌粒要过量,其原因除了使锌与CrCl3充分反应得到CrCl2外,另一个作用是________。仪器Ⅳ的主要作用是___________。
(5)已知实验时取用的CrCl3溶液中含溶质9.51 g,取用的CH3COONa溶液为1.5 L 0.1 mol/L,其他反应物足量。实验后得干燥的[Cr(CH3COO)2]2·2H2O 9.4 g,则该实验所得产品的产率为________(用百分数表示,保留3位有效数字)(不考虑溶解的醋酸亚铬水合物)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com