
【题目】在一定条件下,在密闭容器中,发生可逆反应2NO2(g) ![]() 2NO(g) +O2(g),达到平衡状态的标志是:
2NO(g) +O2(g),达到平衡状态的标志是:
A.单位时间生成n mol O2,同时生成2n mol NO
B.用NO2、NO、O2表示反应速率之比为2:2:1的状态
C.NO2、NO、O2的物质的量之比为2:2:1的状态
D.混合气体的颜色不再改变的状态
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。
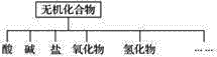
(1)上图所示的物质分类方法名称是____________。
(2)以钠、钾、氢、氧、碳、硫、氮中任两种或三种元素组成合适的物质,分别填在下表中的横线上:
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式__________。
(4)写出实验室由⑩制备氧气的化学方程式______。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
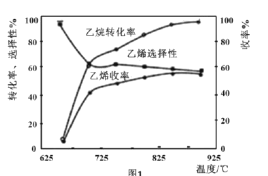
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:
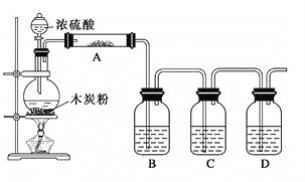
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸的电离常数为1.8×10-5。向20mL2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如图所示。下列说法正确的是( )
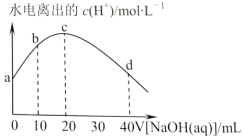
A.a点水电离出的c(H+)=6.0×10-3mol/L
B.b点c(CH3COOH)>c(Na+)>c(CH3COO-)
C.c点恰好完全反应,溶液中无CH3COOH
D.d点c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小组设计如图装置制备NOC1。回答下列相关问题:
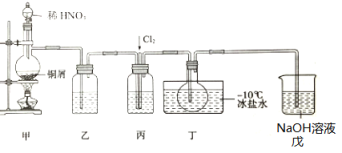
(1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为___。
(2)装置乙中的液体为___,装置丙作用是___。
(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作目的是___。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是___(用化学方程式表示)。
(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250mL溶液;取25.00mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为24.00mL。滴定终点的现象是___,亚硝酰氯(NOCl)的纯度为___。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g) + xB(g)![]() C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=_________。
(2)用A表示该反应的速率为____________________mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______________________(填写下列选项字母符号)。
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)氯胺(NH2Cl)的电子式为___。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=___。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在电离平衡2NH3(l)![]() NH
NH![]() +NH
+NH![]() ,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
(3)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为___(填“放热”或“吸热”)反应,理由是___;
②下列选项中可以说明容器乙已经达到平衡状态的是___(填序号)
A.容器内压强不变
B.容器内气体的密度不变
C.2υ正(NO)=υ逆(N2)
D.混合气体的平均摩尔质量不变
③乙容器在100min达到平衡状态,则0~100min内用NO的浓度变化表示的平均反应速率υ(NO)=___,平衡常数K(400℃)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com