
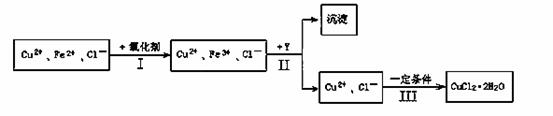
某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下:
一些金属氢氧化物沉淀的PH
| 金属离子 | PH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 4.4 | 4.6 |
化学试剂价格表

回答下列问题:
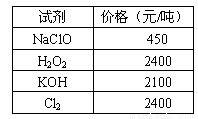
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_______________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北荆门高二上学期期末教学质量检测化学试卷(带解析) 题型:实验题
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL[来源:学+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省苏州五中高三上学期期中考试化学试卷(带解析) 题型:填空题
(15分)某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下: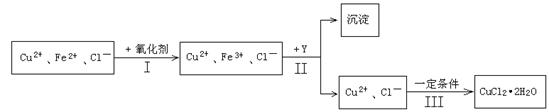
一些金属氢氧化物沉淀的PH
| 金属离子 | PH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 4.4 | 4.6 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分) 某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下:
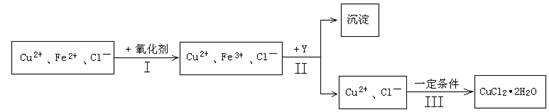
一些金属氢氧化物沉淀的PH
|
金属离子 |
PH |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
4.4 |
4.6 |
化学试剂价格表
回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com