
【题目】NA表示阿伏加德罗常数的值,常温下,抽去右图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是

A.反应前气体的总体积为0. 448 L
B.生成物中含有0.01NA个分子
C.装置中氢元素的总质量为0.04 g
D.生成物完全溶于水后所得溶液含有0.01 NA个F-
【答案】C
【解析】
氨气与氟化氢反应:HF+NH3=NH4F,生成0.01 mol NH4F固体。
A. 常温常压下,气体摩尔体积不是22.4 L/mol,大于22.4 L/mol,故反应前气体的总体积>(0.01 mol+0.01 mol)×22.4 L/mol=0.448 L,A错误;
B. 生成物NH4F为离子化合物,不存在分子,B错误;
C. 装置中n(H)=n(HF)+3n(NH3)=0.01 mol+0.01 mol×3=0.04 mol,故氢元素质量=0.04 mol×1 g/mol=0.04 g,C正确;
D. 0.01 mol HF和0.01 mol NH3恰好反应,生成的NH4F为0.01 mol,氟离子是弱酸的阴离子,在水溶液中发生水解,加水溶解后所得溶液中F-数目小于0.01NA,D错误;
故合理选项是C。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
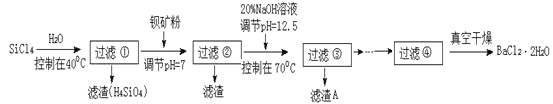
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
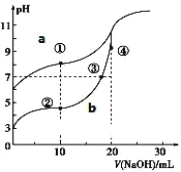
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
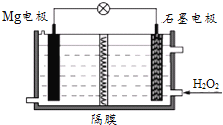
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述不正确的是
Z(g)+W(s) ΔH>0,下列叙述不正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率不变
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( )
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A. ΔH4﹦2ΔH32ΔH2ΔH1
B. O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
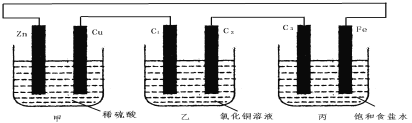
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,萘可被浓硝酸和浓硫酸的混合液硝化生成二硝基化合物,它是1,5二硝基萘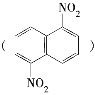 和1,8二硝基萘
和1,8二硝基萘 的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
A.蒸发浓缩结晶B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液D.将滤液缓缓加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
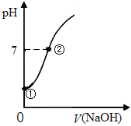
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com