
【题目】在2 L的密闭容器内,500℃时反应2SO2(g)+O2(g) ![]() 2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________________。
(2)下图表示SO3的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出SO3气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(5)若在容积均为2 L的密闭容器内,500℃时按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molSO2、 1molO2 | 2molSO3 | 4molSO2、 2molO2 |
平衡时n(SO3) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | p1 | p2 | p3 |
反应物的转化率 | α1 | α2 | α3 |
三个容器中的反应分别达平衡时下列各组数据关系正确的是____(填字母)。
A.α1+α2=1 B. Q1+Q2=Q C. α3<α1 D. p3<2p1=2p2 E. n2<n3<1.0mol F. Q3=2Q1
(6)在一定条件下进行反应2SO2(g)+O2(g) ![]() 2SO3(g),如图所示。
2SO3(g),如图所示。
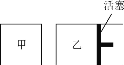
相同温度下,在甲、乙两容器中各投入2molSO2、1molO2,甲、乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲____(填“>”、“<”或“=”,下同)乙,平衡时SO2的转化率:甲____乙。
【答案】![]() b 1.5×10-3 mol·L-1·s-1 bc c ABD > <
b 1.5×10-3 mol·L-1·s-1 bc c ABD > <
【解析】
(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,所以该反应的平衡常数表达式K=![]() ,故答案为:
,故答案为:![]() 。
。
(2)三氧化硫是生成物,平衡时生成三氧化硫的物质的量是0.013mol,其浓度为0.013mol÷2L=0.0065mol/L,所以根据图像可知,表示SO3变化曲线的是b。0s~2s内消耗SO2的物质的量是0.020mol-0.008mol=0.012mol,则根据方程式可知消耗氧气的物质的量是0.006mol,其浓度为0.003mol/L,则用O2表示从0s~2s内该反应的平均速率:v=0.003mol/L÷2s=0.0015mol·L-1·s-1,故答案为:b,1.5×10-3mol·L-1·s-1。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则
a.v(SO3)=2v(O2)符合反应速率之比是相应的化学计量数之比,但不能确定反应速率的方向,不能说明达到平衡状态,故a错误;
b.容器内压强保持不变能说明达到平衡状态,故b正确;
c.v逆(SO2)=2v正(O2)符合反应速率之比是相应的化学计量数之比,且反应速率的方向相反,能说明达到平衡状态,故c正确;
d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内密度保持不变不能说明反应达到平衡状态,故d错误。
故答案为:bc。
(4)a.及时分离出SO3气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小,故a错误;
b.适当升高温度反应速率增大,平衡向吸热反应移动,即平衡向逆反应移动,故b错误;
c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大,故c正确;
d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动,故d错误。
故答案为:c。
(5)A.甲、乙为等效平衡,平衡时O2的物质的量相等,令平衡时O2为amol,甲中O2转化率α1=![]() =1-a,平衡时SO3的物质的量=(1-a)mol,乙中参加反应的SO3为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
=1-a,平衡时SO3的物质的量=(1-a)mol,乙中参加反应的SO3为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
B.甲、乙为等效平衡,平衡时O2的物质的量相等,令平衡时O2为bmol,则甲中参加反应的O2为(1-b)mol,放出的热量Q1=Q(1-b),乙中参加反应的SO3为bmol,吸收的热量Q2=bQ,故Q1+Q2=Q(1-b)+bQ=Q,故B正确;
C.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1,故C错误;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2,故D正确;
E.由D中分析可知,n2=0.5,n3>1.0mol,故E错误;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的O2的物质的量大于甲中的2倍,则Q3>2Q1,故F错误。
故答案为:ABD。
(6)根据图像可知,甲是保持温度和容积不变的,乙是保持温度和压强不变的,因此,在反应过程中,乙中的压强始终大于甲中的压强,所以甲中的反应速率小,达到平衡的时间长,但由于正反应是体积减小的反应,所以压强越大,反应物的转化率越高,故答案为:>,<。


科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
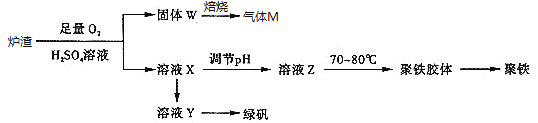
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为_______________________。
(2)A中肯定共面的碳原子数有__个。
(3)若0.1 mol的烃A完全燃烧后,燃烧时消耗标准状况下的氧气____L。
(4)A在催化剂加热条件下发生加聚反应,化学方程式为_______________________________。
(5)在催化剂作用下,与H2加成后的产物名称为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是( )
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Mg2+、Ba2+ 、Ag+和NO3-,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中三种阳离子逐一完全沉淀分离,其流程如右图所示。下列说法正确的是( )

A. 试剂A可能为NaOH溶液
B. 沉淀2只能是BaCO3 ,不可能是Mg(OH)2
C. 每加一种试剂需过量但不需要过滤即可进行下一步
D. 生成沉淀1的离子方程式只能是:Ag+ + Cl- = AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L
B. 从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C. 配制500mL 0.1mol/L的CuSO4溶液,需8.0g硫酸铜固体
D. 0.1mol/L MgCl2溶液中Cl-物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
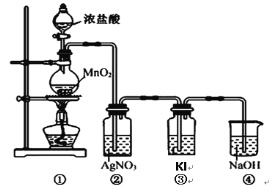
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________、_________除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________(填“能”或者“否”),请说明理由_________。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用![]() Ca轰击
Ca轰击![]() Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A. 第117号元素是副族元素B. ![]() Bk的质量数为97
Bk的质量数为97
C. 第117号元素是非金属元素D. ![]() Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com