
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为__。
【答案】![]() S52+2H+=H2S↑+4S↓ 4FeS2+11O2
S52+2H+=H2S↑+4S↓ 4FeS2+11O2![]() 2Fe2O3+8SO2 +4 S2O52+O2+H2O=2SO42+2H+ Na2CO3+2SO2=Na2S2O5+CO2
2Fe2O3+8SO2 +4 S2O52+O2+H2O=2SO42+2H+ Na2CO3+2SO2=Na2S2O5+CO2
【解析】
Ⅰ.(1)Na2S2为离子化合物,两个S原子间形成一对共用电子,构成[S-S]2-。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,由此可写出反应的离子方程式。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,由此可写出反应的化学方程式。
Ⅱ.(4)焦亚硫酸钠(Na2S2O5)中,钠元素化合价为+1价,氧元素化合价为2价,依据化合物中化合价的代数和为0,可计算得到硫元素的化合价。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸,由此可写出反应的离子方程式。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠、二氧化碳,由此可写出反应的化学方程式。
Ⅰ.(1)Na2S2为离子化合物,两个S原子间形成一对共用电子,电子式为![]() 。答案为:
。答案为:![]() ;
;
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,反应的离子方程式为S52+2H+=H2S↑+4S↓。答案为:S52+2H+=H2S↑+4S↓;
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,反应的化学方程式:4FeS2+11O2![]() 2Fe2O3+8SO2。答案为:4FeS2+11O2
2Fe2O3+8SO2。答案为:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
Ⅱ.(4)焦亚硫酸钠(Na2S2O5)中,钠元素化合价为+1价,氧元素化合价为2价,依据化合物中化合价的代数和为0,可计算得到硫元素的化合价为+4。答案为:+4;
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸,反应的离子方程式:S2O52+O2+H2O=2SO42+2H+。答案为:S2O52+O2+H2O=2SO42+2H+;
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠、二氧化碳,反应的化学方程式:Na2CO3+2SO2=Na2S2O5+CO2。答案为:Na2CO3+2SO2=Na2S2O5+CO2。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空:
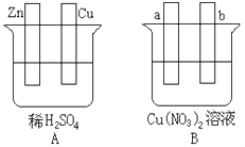
(1)在A图中,使铜片上冒气泡。请加以必要连接,则连接后的装置叫__。电极反应式:锌电极:___;铜电极:__。
(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出:___。加以必要的连接后,该装置叫___。电极反应式:b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值__(升高、降低、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次有机化学课堂小组讨论中,某同学设计了下列合成路线,你认为不可行的是( )
A. 用氯苯合成环己烯:![]()
B. 用甲苯合成苯甲醇:![]()
C. 用乙烯合成乙酸:![]()
D. 用乙烯合成乙二醇:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.1molL-1NaOH溶液500mL,回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是___(填字母),配制上述溶液还需要用到的玻璃仪器是___(填仪器名称)。
(2)配制该NaOH溶液,需要用托盘天平称取NaOH固体___克。
(3)将NaOH固体溶解时用到玻璃棒,其作用是___。
(4)在配制过程中,下列实验操作会引起所配的NaOH溶液的浓度偏大的是___。
A.烧杯未进行洗涤
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
C.往容量瓶转移时,有少量液体溅出
D.在容量瓶中定容时俯视容量瓶刻度线
E.摇匀后静置,发现液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:
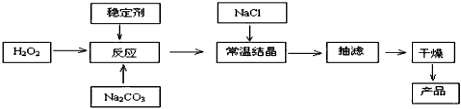
已知:2Na2CO3 + 3H2O2 =2Na2CO3·3H2O2 △H<0
请回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是_________________。
a.MnO2 b.H2S c.稀硫酸 d.NaHCO3
(2)加入NaCl的作用是_________________。
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是_________________。
(4)反应的最佳温度控制在15℃~20℃,温度偏高时造成产率低可能是_________________。
(5)以上流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是_________________。进行该操作的方法是:_________________。
(6)为测定产品的纯度。
准确称取ag产品配成250mL溶液,移取25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释成100mL,作被测试样;用高锰酸钾标准溶液滴定被测试样,MnO4-的还原产物是Mn2+。用cmol/L KMnO4标准溶液VmL滴定待测液,滴定到达终点的现象是________________。
重复滴定三次,平均消耗cmol/L KMnO4标准溶液VmL,则产品中过碳酸钠的质量分数为______________。配制cmol/L KMnO4标准溶液时,移液时有少量液体溅出,则产品的纯度将_________(变大、变小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16g18O2的中子数为10NAB. 1.9g1H37Cl的电子数为0.9NA
C. 7.0g35Cl2的体积为2.24LD. 35Cl2的摩尔质量为70g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
A.B的转化率为20%B.平衡时A的浓度为1.50mol/L
C.x=1D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
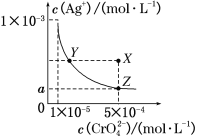
A. T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B. 向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C. 图中a=![]() ×10-4
×10-4
D. T ℃时,Ag2CrO4的Ksp为1×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com