
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
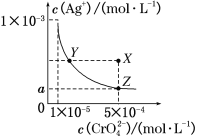
A. T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B. 向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C. 图中a=![]() ×10-4
×10-4
D. T ℃时,Ag2CrO4的Ksp为1×10-8
【答案】D
【解析】
A.一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故A正确;
B.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;
C.依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)c(CrO42-)=1×10-11,Z点时c(CrO42-)=5×10-4,则c2(Ag+)=2×10-8,所以a=![]() ×10-4,故C正确;
×10-4,故C正确;
D.依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag++CrO42-;Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-5=10-11;故D错误。
故选D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用下图装置制取少量氮气。下列说法正确的是
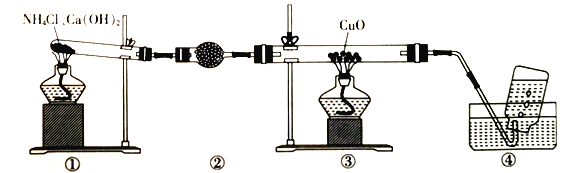
A. ②中盛放的是五氧化二磷
B. 实验开始时先点燃③的酒精灯,再点燃①的酒精灯
C. ③中玻璃管中的反应:2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
D. 实验结束时先熄灭①、③的酒精灯,再将导管从水槽中拿出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的循环和转化对生产、生活有重要价值。
I.氮是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示:

设备1、3中发生反应的化学方程式分别是_________________、_________________;设备2中通入的物质A是__________。
II.氨氮废水的处理是当前科学研究的热点问题之一。氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:

(1)过程①的目的是将NH4+转化成NH3,并通过鼓入大量热空气将氨气吹出,写出NH4+转化成NH3的离子方程式:______________________________
(2)过程②中加入NaClO溶液可将氨氮化合物转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为__________、__________。
(3)图中含余氯废水中含有NaClO,则X可选用__________(填序号)的溶液达到去除余氯的目的。
a.KOH b.Na2SO3 c.KMnO4 d.NaCl
写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓![]() 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
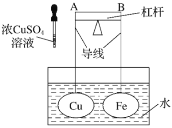
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
D.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物。请回答下列问题:
(1)D在周期表中的位置_____,E的简单阴离子结构示意图______。
(2)C、D、E三种元素简单离子的离子半径由大到小的顺序是_____。
(3)用电子式来表示BA3的形成过程:__________ 。
(4)用含A元素最简单的有机化合物与炽热的氧化铜反应生成一种单质、液态氧化物和一种可以使澄清石灰水变浑浊的气体,其化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积固定的密闭容器中发生可逆反应:A (g)+2B (g)![]() C (s)+D (g),能说明反应已达到平衡状态的事实是
C (s)+D (g),能说明反应已达到平衡状态的事实是
A. 容器内A、B、C、D四者共存 B. νA(正)=2νB(逆)
C. 容器内各种物质的浓度不再改变 D. νA(正)=νC(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。
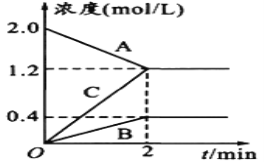
由图中数据
(1)该反应的反应物是___________。
(2)该反应是否可逆反应_____(填“是”或“否”),原因是__________________。写出该反应的化学方程式________________________。
(3)反应开始至2min,用C表示化学平均反应速率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是重要的工业原料,在实验室里探究在高温下绿矾的分解产物。
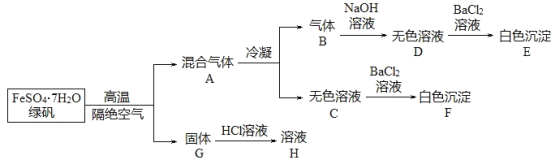
取27.8g绿矾晶体,按上述流程进行实验,测得白色沉淀E和F的质量分别为10.85g和11.65g。
(1)通过计算,写出绿矾隔绝空气高温分解的反应方程式:______。
(2)实验室检验溶液H中金属阳离子的步骤和现象:______。
(3)白色沉淀E在空气中放置一段时间后称量,发现质量大于10.85g,用化学方程式来解释这个现象:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com