
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>乙
C.最外层电子数:甲>乙
D.最高价氧化物的水化物的碱性:丙>丁>戊
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)![]() CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________ 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________________。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) 容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5) a=_____
(6) 下列说法中能说明该反应达到平衡状态的是__________。(填字母)
A. 容器中压强不变 B. 混合气体中c(CH3OCH3) 不变
C. 混合气体的密度不变 D. 单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2![]() CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是__________(填字母)。
A. n﹥2m B. m﹥2 n C. 2m﹥n D. m﹥3n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数的值,下列说法正确的是( )
A. 标准状况下,将6.72L的NO2通入足量的水中转移电子数为0.3NA
B. 常温常压下,22.4LCCl4含有NA个CCl4分子
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2混合物,转移的电子数为NA
D. 18 g D2O所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到环状化合物G,G的实验式为C2H3O,相对分子质量为172,核磁共振氢谱显示只有一个吸收峰。
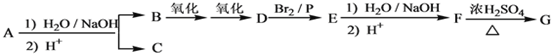
已知:
请回答下列问题:![]()
(1)写出G的分子式:_______________。
(2)写出A的结构简式:______________________。
(3)写出F→G反应的化学方程式: ____________,该反应属于________(填反应类型)。
(4)C的同分异构体有多种。
①属于芳香族化合物,且能发生水解反应的有_____种;
(5)F可以发生下列变化:
![]()
J的结构简式是_________________,由F可以直接生成H,设计反应①和②的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 molL-1的NaOH 溶液,所加NaOH溶液体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A. OC段离子反应方程式:H++OH-==H2O
B. 溶液中 n(NH4+) =0.012 mol
C. 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D. 欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯酚的下列叙述中,错误的是
A. 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶
B. 苯酚是生产电木的单体之一,与甲醛发生缩聚反应
C. 苯酚比苯更易发生苯环上的取代反应
D. 苯酚有毒,也能配制洗涤剂和软药膏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮(C3H60)通常是无色液体,易溶于水,密度小于1g/mL,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com