
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润的红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C;②C+F→D;③D+NaOH![]() F+E+H2O。
F+E+H2O。
(1)写出它们的化学式:A________、C________、D________、F________。
(2)写出下列反应的离子方程式,并按要求填空:
①_____________,这个反应的氧化剂是________,还原剂是________;
③____________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式________。
【答案】 NO2 HNO3 NH4NO3 NH3 3NO2+H2O=2H++2NO3—+NO NO2 NO2 NH4++OH![]() NH3↑+H2O 4NH3+5O2
NH3↑+H2O 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
A、B、C、D、E、F是含有同一种元素的化合物,F是能使湿润的红色石蕊试纸变蓝的气体,则F是NH3,它们之间能发生如下反应:③D+NaOH![]() F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D知,C是HNO3,根据①A+H2O→B+C知,且A和B、C都含有同一种元素,则A是NO2,B是NO,根据物质的性质分析解答。
F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D知,C是HNO3,根据①A+H2O→B+C知,且A和B、C都含有同一种元素,则A是NO2,B是NO,根据物质的性质分析解答。
(1)由上分析,A为NO2,B为NO,C为HNO3,D为NH4NO3,E为NaNO3,F为NH3;
(2)①二氧化氮和水反应生成一氧化氮和硝酸,离子方程式为:3NO2+H2O=2H++2NO3—+NO,该反应中N元素化合价由+4价变为+2价和+5价,所以此反应中氧化剂、还原剂均是NO2;
③为硝酸铵与氢氧化钠反应,方程式为NH4++OH![]() NH3↑+H2O;
NH3↑+H2O;
(3)NH3经催化氧化生成NO和H2O,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl![]() CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________(列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________(用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。
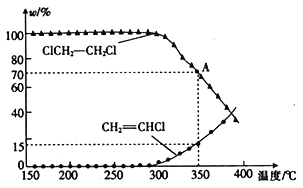
①温度低于290℃时,氯乙烯的产率为0,其原因是______________________;该反应的△H________(填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
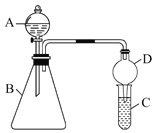
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察C中溶液的现象为__________,写出B中反应的离子方程式__________。
(2)欲证明非金属性:C>Si,若在A中加稀盐酸,则B中加__________。C中加__________溶液(以上均填物质的化学式),观察到C中__________的现象,即可证明。C中反应的离子方程式__________。但小刚认为该实验存在不合理性,请简要说明__________。如何改进__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四组物质的序号按要求填入制定的位置
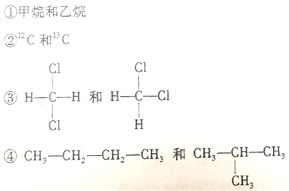
(1)__________组两者互为同位素 (2)_________组两者互为同系物
(3)__________组两者互为同分异构体(4)_________组两者是同一物种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示。
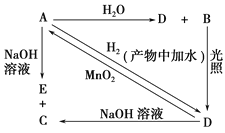
(1)请分别写出A、B、D的化学式(如为溶液请填溶质的化学式):A________、B________、D________;
(2)写出下列反应的化学方程式或离子方程式(请注明条件):
A+H2O(离子方程式):____________________;
A+NaOH(离子方程式):_____________________;
D→A(化学方程式):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米 Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是
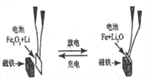
A. 放电时,正极的电极反应式为 Fe2O3+6Li++6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe 作电池的负极,Fe2O3作电池的正极
D. 充电时,Li+向纳米Fe2O3这极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对于平衡体系:2NO2(g)![]() N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
B. 某研究性学习小组为研究酸雨的成分,收集一部分酸雨测其pH,结果一天后再测,发现雨水的pH 减小
C. 光照新制氯水时,溶液的pH 逐渐减小
D. 合成氨工厂通常采用20MPa~50MPa 的高压,以提高原料的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com