
【题目】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl![]() CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________(列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________(用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。
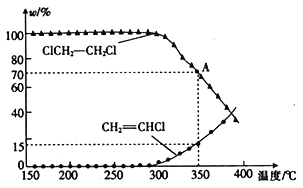
①温度低于290℃时,氯乙烯的产率为0,其原因是______________________;该反应的△H________(填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________(任写两条)。
【答案】 ![]() 耗能大、原料成本高(或催化剂氯化汞毒性大等合理答案) 2△H1+△H2+4△H3 1,2-二氯乙烷未开始裂解(或其他合理答案) > 3.25 kPa 减小体系的总压强、及时移出氯乙烯(或将HCl溶解除去或升高温度)
耗能大、原料成本高(或催化剂氯化汞毒性大等合理答案) 2△H1+△H2+4△H3 1,2-二氯乙烷未开始裂解(或其他合理答案) > 3.25 kPa 减小体系的总压强、及时移出氯乙烯(或将HCl溶解除去或升高温度)
【解析】(1) ① CaC2是离子化合物,由乙炔的结构可推知乙炔钙的电子式为![]() ;② 该方法的缺点是耗能大、原料成本高、催化剂毒性大等;
;② 该方法的缺点是耗能大、原料成本高、催化剂毒性大等;
(2)根据已知的三个反应,利用盖斯定律① ×2+② +③×4即得总反应,所以△H4=2△H1+△H2 + 4△H3;
(3) ①温度低于290℃时,氯乙烯的产率为0,可能是温度低,1,2-二氯乙烷分子没有达到活化分子所需要的最低能量,所有的化学键都没有断裂,因此氯乙烯的产率为0;该反应为分解反应,所以是吸热反应,即△H>0;② 设1,2-二氯乙烷的起始物质的量为1mol, 根据A点对应的两物质的分数可得n(ClCH2-CH2Cl)= ![]() mol,n(CH2=CHCl) =n(HCl) =
mol,n(CH2=CHCl) =n(HCl) = ![]() mol,即n总=
mol,即n总= ![]() mol,所以p(ClCH2-CH2Cl)=101 kPa×0.7=70.7 kPa,p(CH2=CHCl)= 101 kPa×0.15=15.15 kPa=p(HCl),所以Kp =
mol,所以p(ClCH2-CH2Cl)=101 kPa×0.7=70.7 kPa,p(CH2=CHCl)= 101 kPa×0.15=15.15 kPa=p(HCl),所以Kp = ![]() =
= ![]() = 3.25 kPa;③ 为了进一步提高氯乙烯的产率,由于该反应是气体体积增大的反应,可适当减小体系的总压强,或及时移出产物氯乙烯,或将HCl溶解而除去,或根据图象也可以适当升高温度。
= 3.25 kPa;③ 为了进一步提高氯乙烯的产率,由于该反应是气体体积增大的反应,可适当减小体系的总压强,或及时移出产物氯乙烯,或将HCl溶解而除去,或根据图象也可以适当升高温度。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
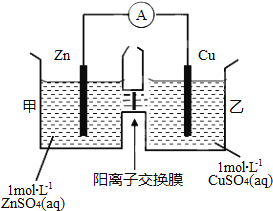
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g)ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
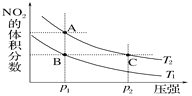
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A>C
D. 由状态B到状态A,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞内含有多种有机物,下图表示细胞内有机物的元素组成和功能的关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,x、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)I在小麦种子中主要是指____________,I在动物细胞中主要是指____________。若物质R与I具有相似功能,并且在动物、植物细胞均含有,不仅含能量多而且体积较小,则物质R是____________。
(2)与Y相比,Z特有的成分有____________。
(3)P通过____________反应形成Ⅳ,此过程生成的H2O中H原子来自P的____________(基团)。
(4)Ⅳ结构不同的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润的红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C;②C+F→D;③D+NaOH![]() F+E+H2O。
F+E+H2O。
(1)写出它们的化学式:A________、C________、D________、F________。
(2)写出下列反应的离子方程式,并按要求填空:
①_____________,这个反应的氧化剂是________,还原剂是________;
③____________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com