
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
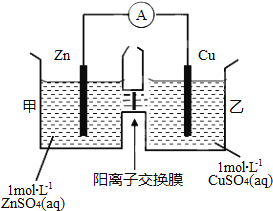
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难落于水的物质,能熔于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按 照气流由左到右的方向,上述装置合理的连接顺序为a →____ →____ →f→g→_____ →____→d→e→j。(填仪器接口字母)_____________
(2)装置A中导管m的作用是________________________________。
(3)装置D中除生成TiCl4 外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________________________________。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:________________________________。
(5)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 新制饱和氯水中:Al3+、Cu2+、SO42-、Br-
B. 使甲基橙变红的溶液中:Mg2+、Fe3+、NO3-、SCN-
C.  =1×10-13mol·L-1的溶液中:Na+、K+、C1-、AlO2-
=1×10-13mol·L-1的溶液中:Na+、K+、C1-、AlO2-
D. 由水电离的c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接煤一空气燃料电池原理如图所示,下列说法错误的是( )
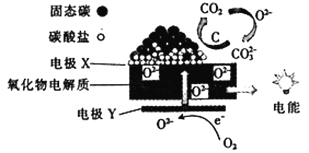
A. 随着反应的进行,氧化物电解质的量不断减少
B. 负极的电极反应式为C+2CO32--4e-=3CO2↑
C. 电极X为负极,O2-向X极迁移
D. 直接煤一空气燃料电池的能量效率比煤燃烧发电的能量效率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg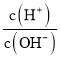 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是( )
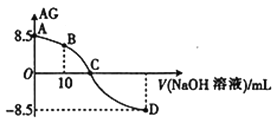
A. D点溶液中的pH=11.25
B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20.00mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl![]() CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________(列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________(用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。
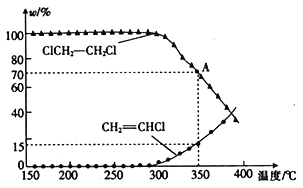
①温度低于290℃时,氯乙烯的产率为0,其原因是______________________;该反应的△H________(填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四组物质的序号按要求填入制定的位置
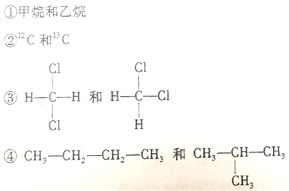
(1)__________组两者互为同位素 (2)_________组两者互为同系物
(3)__________组两者互为同分异构体(4)_________组两者是同一物种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com