
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。

【答案】 3s23p4 M 正四面体 sp3 CCl4或SiF4等 均为分子晶体,而氨气分子间有氢键,H2S分子间没有氢键 N>O>S 16NA Ti4CN3 顶点和前后左右面心
【解析】试题分析:(1)基态S原子最外层有6个电子,排布在3s、3p能级上;离原子核越远能量越高;(2)根据价电子对数判断S原子轨道杂化方式;根据价电子理论判断SO42-空间构型;等电子体是指具有相同价电子数目和原子数目的分子或离子;(3)氨气分子间有氢键;(4)N原子2p轨道为半充满状态,所以第一电离能大于相邻的O原子;同主族元素从上到下第一电离能逐渐减小,所以第一电离能O大于S原子;(5)Cu和N之间是配位键、N和H之间是共价键,单键都是σ键;(6)根据均摊法计算化学式;根据晶胞结构分析氮原子在新晶胞中的位置。
解析:(1)基态S原子最外层有6个电子,排布在3s、3p能级上,所以基态S原子的价电子排布式为3s23p4;离原子核越远能量越高,能量最高的电子所处的能层是第三层,符号为M;(2)S原子的价电子对数是![]() ,孤对电子为0,所以SO42-空间构型正四面体; S原子轨道杂化方式为sp3;等电子体是指具有相同价电子数目和原子数目的分子或离子,所以与SO42-互为等电子体的分子的化学式是CCl4或SiF4;(3)氨气分子间有氢键,H2S分子间没有氢键,所以氨气的沸点高于硫化氢的沸点;(4)N原子2p轨道为半充满状态,所以第一电离能大于相邻的O原子,同主族元素从上到下第一电离能逐渐减小,所以第一电离能O大于S原子,所以O、N、S的第一电离能从大到小的顺序是N>O>S;(5)Cu和N之间是配位键、N和H之间是共价键,单键都是σ键,所以1mol的[Cu(NH3)4]2+中σ键的个数为16 NA;(6)
,孤对电子为0,所以SO42-空间构型正四面体; S原子轨道杂化方式为sp3;等电子体是指具有相同价电子数目和原子数目的分子或离子,所以与SO42-互为等电子体的分子的化学式是CCl4或SiF4;(3)氨气分子间有氢键,H2S分子间没有氢键,所以氨气的沸点高于硫化氢的沸点;(4)N原子2p轨道为半充满状态,所以第一电离能大于相邻的O原子,同主族元素从上到下第一电离能逐渐减小,所以第一电离能O大于S原子,所以O、N、S的第一电离能从大到小的顺序是N>O>S;(5)Cu和N之间是配位键、N和H之间是共价键,单键都是σ键,所以1mol的[Cu(NH3)4]2+中σ键的个数为16 NA;(6)![]() 原子数是
原子数是![]() 、N原子数是
、N原子数是![]() 、C原子数是
、C原子数是![]() ,化学式是Ti4CN3;根据晶胞结构,若碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是顶点和前后左右面心。
,化学式是Ti4CN3;根据晶胞结构,若碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是顶点和前后左右面心。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 新制饱和氯水中:Al3+、Cu2+、SO42-、Br-
B. 使甲基橙变红的溶液中:Mg2+、Fe3+、NO3-、SCN-
C.  =1×10-13mol·L-1的溶液中:Na+、K+、C1-、AlO2-
=1×10-13mol·L-1的溶液中:Na+、K+、C1-、AlO2-
D. 由水电离的c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl![]() CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________(列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________(用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。
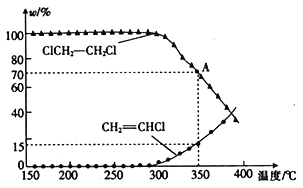
①温度低于290℃时,氯乙烯的产率为0,其原因是______________________;该反应的△H________(填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实数室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。
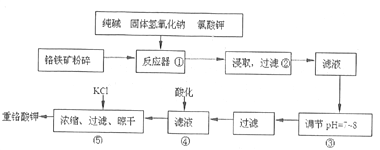
涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)进入反应器①之前将铬铁矿粉碎的目的是____________________________。
(2)步骤②过滤得到的滤渣主要成分是_______________。过滤所需的玻璃仪器有_________________。
(3)操作④中酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________________。
(4)操作③调节溶液pH=7~8的目的是_________________________。
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72-的废水,原理示意图如下图。

B为电解池的________极,写出阳极的电极反应式____________________。阳极区域溶液中发生反应的离子方程式为____________________________________。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,则溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
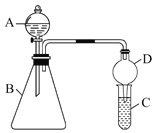
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察C中溶液的现象为__________,写出B中反应的离子方程式__________。
(2)欲证明非金属性:C>Si,若在A中加稀盐酸,则B中加__________。C中加__________溶液(以上均填物质的化学式),观察到C中__________的现象,即可证明。C中反应的离子方程式__________。但小刚认为该实验存在不合理性,请简要说明__________。如何改进__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四组物质的序号按要求填入制定的位置
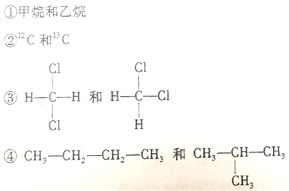
(1)__________组两者互为同位素 (2)_________组两者互为同系物
(3)__________组两者互为同分异构体(4)_________组两者是同一物种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com