
����Ŀ���ظ�����ǹ�ҵ������ʵ���ҵ���Ҫ����������ҵ�ϳ��ø�����(��Ҫ�ɷ�ΪFeO��Cr2O3������ΪSiO2��Al2O3)Ϊԭ����������ʵ����ģ�ҵ���ø�������K2Cr2O7����Ҫ��������ͼ��
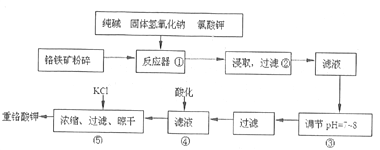
�漰����Ҫ��Ӧ�ǣ�6FeO��Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O��
12Na2CrO4+3Fe2O3+7KC1+12H2O��
��1�����뷴Ӧ����֮ǰ������������Ŀ����____________________________��
��2������ڹ��˵õ���������Ҫ�ɷ���_______________����������IJ���������_________________��
��3�����������ữʱ��CrO42-ת��ΪCr2O72-��д��ƽ��ת�������ӷ���ʽ��_________________________��
��4�������۵�����ҺpH=7~8��Ŀ����_________________________��
��5����ҵ��Ҳ���õ�ⷨ�������Ժ�����ˮ����������ۣ��������缫������ʢ�����Ժ�Cr2O72-�ķ�ˮ��ԭ��ʾ��ͼ����ͼ��

BΪ���ص�________����д�������ĵ缫��Ӧʽ____________________������������Һ�з�����Ӧ�����ӷ���ʽΪ____________________________________��Ϊ��ʹCr3+��Fe3+ת��ΪFe(OH)3��Cr(OH)3��������Ӧ�����Һ�м���һ�������ռ����Һ��c(Fe3+)=1.0��10-12mo1��L-1,����Һ��c(Cr3+)=_________mo1��L-1��{����Ksp[Fe(OH)3]=4.0��10-28��Ksp[Cr(OH)3]=6.0��10-31}
���𰸡� ����Ӵ�������Ӷ��ӿ컯ѧ��Ӧ���ʺ����ԭ�ϵ������� Fe2O3 �ձ���©���������� 2CrO42-+2H��![]() Cr2O72-+H2O ����������Ӻ�ƫ���������ת��Ϊ��������ȥ �� Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5��10��5
Cr2O72-+H2O ����������Ӻ�ƫ���������ת��Ϊ��������ȥ �� Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5��10��5
�������������������1������������������������Ӵ��������2���ڷ�Ӧ������Ҫ����6FeO��Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O�� SiO2��Al2O3��NaOH��Ӧ�ֱ�ת��ΪNa2SiO3��NaAlO2,������ֻ��Fe2O3������ˮ�����ݹ���װ�÷�������IJ�����������3�����������ữʱ��CrO42-ת��ΪCr2O72-������Ԫ���غ�������غ���ƽת�������ӷ���ʽ����4��������ҺpH=7~8���Խ���������Ӻ�ƫ���������ת��Ϊ��������ȥ����5��B�缫��������������B����������������Fe2+������������Һ��Fe2+��Cr2O72-��ԭΪCr3+������
12Na2CrO4+3Fe2O3+7KC1+12H2O�� SiO2��Al2O3��NaOH��Ӧ�ֱ�ת��ΪNa2SiO3��NaAlO2,������ֻ��Fe2O3������ˮ�����ݹ���װ�÷�������IJ�����������3�����������ữʱ��CrO42-ת��ΪCr2O72-������Ԫ���غ�������غ���ƽת�������ӷ���ʽ����4��������ҺpH=7~8���Խ���������Ӻ�ƫ���������ת��Ϊ��������ȥ����5��B�缫��������������B����������������Fe2+������������Һ��Fe2+��Cr2O72-��ԭΪCr3+������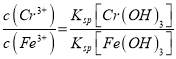 ����c(Cr3+)��
����c(Cr3+)��
��������1������������������������Ӵ����������Ӧ���ʺ����ԭ�ϵ�����������2����Ӧ������Ҫ����6FeO��Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O�� SiO2��Al2O3��NaOH��Ӧ�ֱ�ת��ΪNa2SiO3��NaAlO2,������ֻ��Fe2O3������ˮ������������Fe2O3����������IJ����������ձ���©��������������3�����������ữʱ��CrO42-ת��ΪCr2O72-������Ԫ���غ�������غ㣬��Ӧ�����ӷ���ʽ��2CrO42-+2H��
12Na2CrO4+3Fe2O3+7KC1+12H2O�� SiO2��Al2O3��NaOH��Ӧ�ֱ�ת��ΪNa2SiO3��NaAlO2,������ֻ��Fe2O3������ˮ������������Fe2O3����������IJ����������ձ���©��������������3�����������ữʱ��CrO42-ת��ΪCr2O72-������Ԫ���غ�������غ㣬��Ӧ�����ӷ���ʽ��2CrO42-+2H��![]() Cr2O72-+H2O����4��������ҺpH=7~8���Խ���������Ӻ�ƫ���������ת��Ϊ��������ȥ����5��B�缫��������������B��������������ʧ���������������ӣ��缫��ӦʽΪFe-2e-= Fe2+������������Һ��Fe2+��Cr2O72-��ԭΪCr3+����Ӧ����ʽ��Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O��
Cr2O72-+H2O����4��������ҺpH=7~8���Խ���������Ӻ�ƫ���������ת��Ϊ��������ȥ����5��B�缫��������������B��������������ʧ���������������ӣ��缫��ӦʽΪFe-2e-= Fe2+������������Һ��Fe2+��Cr2O72-��ԭΪCr3+����Ӧ����ʽ��Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O�� 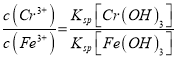 ��
�� ![]() ��c(Cr3+)=1.5��10��5��
��c(Cr3+)=1.5��10��5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������8�֣����в���Ԫ�ص�������ԭ��(�����)�ṹ���±���
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
T | �����������Ǵ�����������3�� |
X | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��������Ԫ�صļ������а뾶��С |
(1)д��Ԫ��T��ԭ�ӽṹʾ��ͼ ��
(2)Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________(�����)��
a��Y���ʵ��۵��Z���ʵ�
b��Y�Ļ��ϼ۱�Z��
c��Y������ˮ��Ӧ��Z���ʾ���
d��Y����������ˮ����ļ��Ա�Zǿ
(3)T��X��Y��Z��������Ԫ�����γɼ������Ӽ����зǼ��Թ��ۼ��Ļ����д���û�����ĵ���ʽ��_____ _________��
(4)Ԫ��T����Ԫ�ؿ��γ�һ��18���ӵĻ�����Q��Ԫ��X����Ԫ��Ҳ�ܰ�ԭ�Ӹ�����Ϊ1��2�γ�һ��18���ӻ�����W��Q��W����������ԭ��Ӧ������X���ʺ�T����һ���⻯�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ָ������������½���ѧ��ת��Ϊ���ܵ�װ�ã��乤��ԭ����ͼ��ʾ�������й������ص�˵��������� ( )

A. ������Ӧ����CO2����
B. ����ٽ��˷�Ӧ�е��ӵ�ת��
C. ����ͨ������Ĥ�Ӹ���������������
D. ����ܷ�ӦΪC6H12O6��6O2===6CO2��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���ں��ж����л����ͼ��ʾϸ�����л����Ԫ����ɺ��ܵĹ�ϵ������A��B����Ԫ�أ������������ӣ�x��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺

(1)I��С����������Ҫ��ָ____________��I�ڶ���ϸ������Ҫ��ָ____________��������R��I�������ƹ��ܣ������ڶ��ֲ��ϸ�������У���������������������С��������R��____________��
(2)��Y��ȣ�Z���еijɷ���____________��
(3)Pͨ��____________��Ӧ�γɢ����˹������ɵ�H2O��Hԭ������P��____________(����)��
(4)���ṹ��ͬ��ԭ����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4���Ʊ��Ѽ��仯�������Ҫ�м�����ijС��ͬѧ��������װ����ʵ�����Ʊ�TiCl4�����ʵ������(�г�װ����ȥ)��

�����Ϣ���±���ʾ��
������ | �۵�/�� | �е�/�� | �ܶ�/g��cm-3 | ˮ���� |
TiCl4 | -25 | 136 | 1.5 | ��ˮ������������ˮ���������������л��ܼ� |
CCl4 | -25 | 76.8 | 1.6 | ������ˮ |
��ش��������⣺
��1���������������ҵķ���������װ�ú���������˳��Ϊa�� �� ��f��g�� �� ��d��e��j��(������������ĸ)_____________
��2������������ʵ��װ�ý���ʵ����ʵ�鲽�����£����װ�������Ժ���װ��ҩƷ;__________(����ȷ��˳���������в��������)��
���رշ�Һ©������ ����Һ©������
��ֹͣ�����������ȴ ������װ��D���մɹ�
��3��װ��A�е���m��������________________��
��4��װ��D�г�����TiCl4����ͬʱ����һ����̬���������������÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��5�����ʵ��֤��װ��E���ռ�����Һ���к���TiCl4��___________________________________��
��6���Ƶõ�TiCl4�г���������CCl4���ӻ��Һ���з����TiCl4�IJ�������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������[(NH4)2SO4]һ�������ĵ���(�׳Ʒ����)��������һ�������������ʹ֦Ҷ������ʢ����߹�ʵƷ�ʺͲ�������ǿ������ֺ��ĵֿ��������������ʡ��ʺ��ַʣ������������ڼ��ȵ������¿������ɰ�����������ѧ֪ʶ�ش��������⣺
��1����̬Sԭ�ӵļ۵����Ų�ʽΪ____________��������ߵĵ����������ܲ�ķ���Ϊ_________��
��2��SO42-�ռ乹��Ϊ__________������ԭ�ӵĹ���ӻ���ʽ��________��д��һ����SO42-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ__________��
��3�������ķе�(-33.5��)��������ķе�(-60.4��)����Ҫԭ���ǣ�_____________________________��
��4��O��N��S�ĵ�һ�����ܴӴ�С��˳����___________________��
��5������ͭ��Һ��ͨ������İ���������[Cu(NH3)4]SO4,1mol��[Cu(NH3)4]2+�������ĸ���Ϊ________��
��6�������Ȼ��ѡ�̼���ơ�����������ԭ�ϣ���������̼�����ѻ������ṹ����ͼ��ʾ������̼�����ѻ�����Ļ�ѧʽΪ________�������þ���ľ��������иʹ̼ԭ��λ���¾������������ģ���ԭ�����¾����е�λ����__________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E��F��G��H���ֶ���������Ԫ�أ�ԭ��������������A������Ԫ����ԭ�Ӱ뾶��С��Ԫ�ء�B��C��Dͬ����������,C����̬�⻯���ˮ��Һ�Լ��ԡ�E��ͬ����Ԫ���н�������ǿ��Ԫ�ء�F���������������ǿ����������ǿ�G��һ����������ʹƷ����Һ��ɫ����Gԭ�ӵ�M���������K���������3������Ҫ��ش��������⣺
��1�� CԪ�������ڱ���λ��_________��Fԭ�ӵ�ԭ�ӽṹʾ��ͼ��________��
��2��E��D�γɵĻ�����E2D2�ĵ���ʽ��_______��B��D�γɵĻ�����BD2�Ľṹʽ��_____��
��3��B��G��H����Ԫ������������ˮ��������Դ�ǿ������˳����________��E���ڵ����������Ӱ뾶��С����________��(����Ӧ��Ļ�ѧʽ�����ӷ��Żش�����)
��4��G��һ����������ʹ���Ը��������Һ��ɫ����Ӧ�����ӷ���ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������HCl��H2O��NH3�������ʣ����Ƕ�����1mol��ԭ�ӣ����������ʵ����ʵ���֮��Ϊ�� ��
A.1��1��1B.6��3��2C.3��2��1D.1��2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������ͼ�ش�٢ڣ�
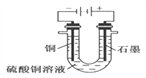
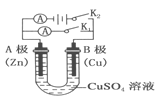
�ٶϿ� K2���պ� K1��B ���ĵ缫��ӦʽΪ__________��
�ڶϿ� K1���պ� K2��B ���ĵ缫��ӦʽΪ__________��
(2)������ͼ�ش�ۢܣ�
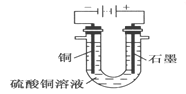
�۽��ϴ�����CuSO4��Һ������ͼ2 ��ʾ��װ���н��е���ⷴӦ�����ӷ���ʽΪ___________________��
��ʵ����ɺ�ͭ�缫����a g��ʯī�缫������״���µ��������________L��
(3)�����������(S2O42-)Ϊý�飬ʹ�ü�ӵ绯ѧ��Ҳ�ɴ���ȼú�����е� NO)��װ����ͼ��ʾ��
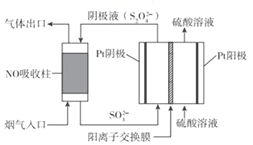
�������ĵ缫��ӦʽΪ_________��
(4)��п���Ե�صĵ������ҺΪ KOH ��Һ����طŵ�ʱ������ Ag2O2 (Ag Ϊ+2��) ת��ΪAg ��������Znת��ΪK2Zn(OH)4��д���õ���ܷ�Ӧ����ʽ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com