
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe===3Fe2+
2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+
加入铁屑的作用是_________________________________________________。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在________范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭 、氯气反应生成液态TiCl4和CO气体的热化学方程式:______________________________________
、氯气反应生成液态TiCl4和CO气体的热化学方程式:______________________________________ ___________________________。
___________________________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项)。 (6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
解析 (1)由题目所给的反应可以看出加入铁屑使溶液中的Fe3+转化为Fe2+,保护TiO2+不被Fe3+氧化。
(3)由Ksp[Fe(OH)3]=2.79×10-39可得c(Fe3+)·c3(OH-)=2.79×10-39
K=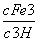 =
=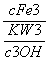 =
=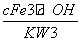
=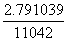 =2.79×103。
=2.79×103。
(4)利用盖斯定律:两个热化学方程式相加即得所要的热化学方程式TiO2(s)+2Cl2(g)+2C(s)===TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1。
(5)由工业流程图可以得出该生产过程中产生了工业三废。
(6)TiCl4与SiCl4的沸点差异很大,所以采用蒸馏的方法进行分离。答案 (1)使Fe3+还原为Fe2+;保护TiO2+不被Fe3+氧化 (2)10-9 m~10-7 m(或其他合理答案) (3)2.79×103 (4)TiO2(s)+2Cl2(g)+2C(s)===TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1。 (5)产生三废(或其他合理答案) (6)蒸馏(或分馏或精馏)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
LiFePO4新型锂离子动力电池是绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向正极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是 ( )。
A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA
C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.6  NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中,能大量共存的一组离子或分子是 ( )。
A.Mg2+、Na+、ClO-、NO3-
B.Al3+、NH4+、Br-、Cl-
C.K+、Cr2O72-、CH3CHO、SO42-
D.Na+、K+、SiO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应反应的离子方程式中,不正确的是 ( )。
A.向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-
NaOH溶液:Mg2++2HCO3-+4OH-
===Mg(OH)2↓+2CO32-+2H2O
B.向NH4Al(SO4)2溶液中滴入B a(OH)2溶液恰好使SO42-反应完全:2Ba2+
a(OH)2溶液恰好使SO42-反应完全:2Ba2+
+4OH-+Al3++2SO42-===2BaSO4↓+AlO2-+2H2O
C.FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用 电解法可回收WC和Co。工艺流程简图如下:
电解法可回收WC和Co。工艺流程简图如下:

 (1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为____________________________________________________。
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为____________________________________________________。
(2)净化步骤所得滤饼的主要成分是____________。回收的洗涤液代替 水配制电解液,目的是回收利用其中的____________。
水配制电解液,目的是回收利用其中的____________。
(3)溶液Ⅰ的主要成分是____________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是_______________________ _________________________________________________。
(4)将Co2O3还原成Co粉的化学反应方程式为________________________ _________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和叙述II均正确且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】 NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
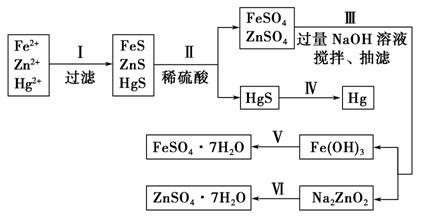
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________。
(2)步骤Ⅲ中抽滤的目的是____________,该步骤产生Fe(OH)3的反应的离子方程式为_________________ _____________________________________。
_____________________________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为___________________________ _____________________________________________________________。
(4)欲实现步骤Ⅴ,需加入的试剂有________、________,所涉及的主要操作依次为__________________________________________________________。
(5)步骤Ⅳ常用的方法是________,该步骤是否对环境有影响?________(填“是”或“否 ”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,
 由快到慢的是顺序是_____________(用“>”表示)。
由快到慢的是顺序是_____________(用“>”表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com