
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
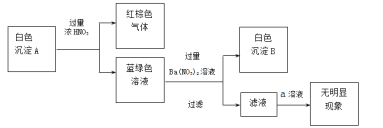
请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN-= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
【答案】Cu+2Fe3+=Cu2++2Fe2+ BaSO4 +1价铜也可将浓HNO3还原 AgNO3 2Cu2++4SCN-=2CuSCN↓+(SCN)2 Cu和Fe3+反应生成Cu2+使c(Fe3+)减小;Cu2+和SCN-反应生成CuSCN沉淀使c(SCN-)减小,均使该平衡正向移动,导致Fe(SCN)3浓度减小,溶液红色褪去 Fe3+有剩余 空气中的O2将Fe2+氧化;(SCN)2将Fe2+氧化
【解析】
(1)铁离子具有氧化性,能够把铜氧化为铜离子;
(2)I.①不溶于稀硝酸的白的沉淀为硫酸钡;
Ⅱ.②亚铜离子具有还原性,也能被硝酸氧化;
Ⅲ.检验氯离子,应加入硝酸银溶液;
②据电子守恒、电荷守恒、原子守恒,写出反应的方程式;
③根据浓度对平衡移动规律进行分析;
(3)亚铁离子具有强还原性,空气中氧气、溶液中(SCN)2都有可能把亚铁离子氧化为铁离子。
![]() 甲同学向
甲同学向![]() 溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了氧化还原反应,生成
溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了氧化还原反应,生成![]() ,其离子方程式是Cu+2Fe3+=Cu2++2Fe2+;
,其离子方程式是Cu+2Fe3+=Cu2++2Fe2+;
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
![]() ⅠA可能为CuCl和
ⅠA可能为CuCl和![]() 其中硫元素的化合价为
其中硫元素的化合价为![]() 价
价![]() 中的一种或两种,白色沉淀与过量浓硝酸反应生成红棕色的
中的一种或两种,白色沉淀与过量浓硝酸反应生成红棕色的![]() 和含
和含![]() 的蓝色溶液,向蓝色溶液中加入过量硝酸钡溶液,生成不溶于硝酸的钡盐沉淀,则白色沉淀B是
的蓝色溶液,向蓝色溶液中加入过量硝酸钡溶液,生成不溶于硝酸的钡盐沉淀,则白色沉淀B是![]() ;
;
故答案为:![]() ;
;
Ⅱ ![]() 价铜也可将浓
价铜也可将浓![]() 还原,故仅根据白色沉淀A与过量浓
还原,故仅根据白色沉淀A与过量浓![]() 反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,
反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,
故答案为:![]() 价铜也可将浓
价铜也可将浓![]() 还原;
还原;
Ⅲ检验氯离子,应加入硝酸银溶液,则a是![]() ,
,
故答案为:![]() ;
;
![]() 据电子守恒、电荷守恒、原子守恒,该反应的方程式为2Cu2++4SCN-=2CuSCN↓+(SCN)2,
据电子守恒、电荷守恒、原子守恒,该反应的方程式为2Cu2++4SCN-=2CuSCN↓+(SCN)2,
故答案为:2Cu2++4SCN-=2CuSCN↓+(SCN)2;
![]() 和
和![]() 反应生成
反应生成![]() 使
使![]() 减小;
减小;![]() 和
和![]() 反应生成CuSCN沉淀使
反应生成CuSCN沉淀使![]() 减小,均使该平衡正向移动,导致
减小,均使该平衡正向移动,导致![]() 浓度减小,溶液红色褪去,
浓度减小,溶液红色褪去,
故答案为:Cu和Fe3+反应生成Cu2+使c(Fe3+)减小;Cu2+和SCN-反应生成CuSCN沉淀使c(SCN-)减小,均使该平衡正向移动,导致Fe(SCN)3浓度减小,溶液红色褪去 ;
![]() 将KSCN溶液滴入
将KSCN溶液滴入![]() 所得的溶液中,观察到溶液变红色,则溶液含
所得的溶液中,观察到溶液变红色,则溶液含![]() ,溶液变红的可能原因是
,溶液变红的可能原因是![]() 有剩余;空气中的
有剩余;空气中的![]() 将
将![]() 氧化;
氧化;![]() 将
将![]() 氧化,
氧化,
故答案为:Fe3+有剩余;空气中的O2将Fe2+氧化;(SCN)2将Fe2+氧化
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在 100 mL 12 mol·L-1 的浓硝酸中加入足量的铁粉,最终产生标准状况下气体的体积为(不考虑 NO2 转化为 N2O4)( )
A.介于 6.72 L 至 13.44 L 之间
B.等于 6.72 L
C.等于 13.44 L
D.几乎无气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
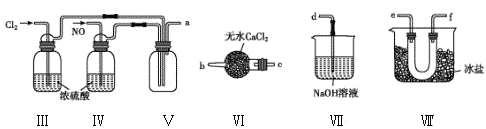
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下合成路线,甲经二步转化为丙:
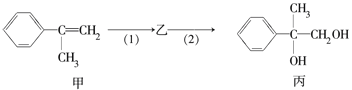
下列叙述错误的是
A. 甲和丙均可与酸性KMnO4溶液发生反应
B. 反应(1)的无机试剂是液溴,铁作催化剂
C. 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D. 反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
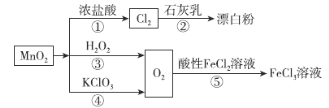
A.反应①中氧化剂与还原剂的物质的量之比为1:4
B.反应①②③④⑤均属于氧化还原反应
C.生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应⑤的离子反应方程式为2Fe2++O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
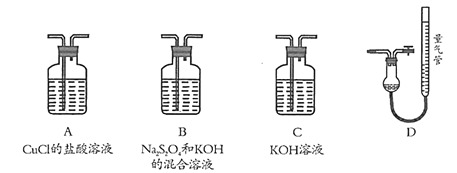
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在日常生活中有广泛应用。漂白液通常用于家庭和公共场所的消毒,某品牌漂白液的包装说明如下:

(1)该漂白液中,NaClO的物质的量浓度约为___ mol·L-1。
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式___,制取500mL此漂白液,需要5.0mol·L-1的NaOH溶液___mL。
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,CuSO4(s)和 CuSO4·5H2O(s)溶于水及CuSO4·5H2O受热分解的能量变化如图所示,下列说法不正确的是
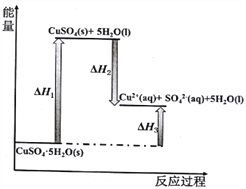
A. 将CuSO4·5H2O(s)溶于水会使溶液温度降低
B. 将CuSO4(s)溶于水会使溶液温度升高
C. △H3>△H2
D. △H1=△H2+△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com