
【题目】工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
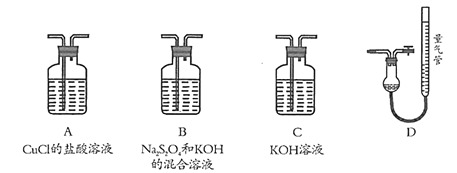
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
【答案】C→B→A 温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切
【解析】
(1)可用KOH吸收二氧化碳,然后用B吸收氧气,再用A吸收CO,最后用排水法测量氮气的体积;
(2)用D装置测N2含量,应注意温度在常温,且左右液面相平,读数时视线与凹液面最低处水平相切。
(1)氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故C中盛放氢氧化钠溶液吸收二氧化碳,B中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,A中盛放CuCl的盐酸溶液吸收CO,D测定氮气的体积,装置的连接顺序应为C→B→A→D;
(2)用D装置测N2含量,读数时应注意温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】BrF3是应用最广泛的一种卤素互化物,还是一种很好的溶剂,它能与H2O反应生成Br2、HBrO3、O2和HF。下列说法正确的是( )
A.该反应中,有三种元素化合价发生改变
B.该反应的还原剂为BrF3,氧化产物为O2
C.生成0.1molO2,有0.4mole-转移
D.0.9molBrF3参加反应,被H2O还原的BrF3为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
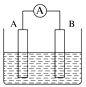
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是________(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:______________________________。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式:__________________________;该电池在工作时,A电极的质量将________(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:___________________________________;该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:___________________________________;若该电池反应消耗了6.4克CH4,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
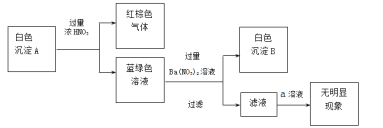
请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN-= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~D等几种烃分子的球棍模型如图所示,据此回答下列问题。
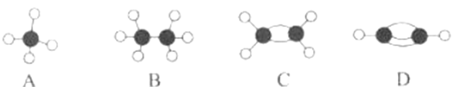
(1)D的分子式为__,A的二氯取代物有__种。
(2)分子中所有原子共平面的是__(填序号)。C可以通过加聚反应生成一种常见的高分子材料,写出该反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取少量溴苯,试填写下列空白。

(1)在烧瓶a中装的试剂是铁粉、______和_____。
(2)请你推测长直导管b的作用:__。
(3)请你分析导管c的下口可否浸没于液面中_____?为什么?_____。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有_____生成,此现象说明这种获得溴苯的反应属于_____。(填有机反应类型)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,把1mol A和1 mol B混合发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A.x的值为2B.A的转化率为40%
C.B的平衡浓度为0.8 mol/LD.D的体积分数为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一些物质之间存在如图所示的三角关系:
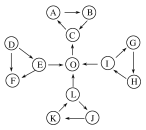
①图中每个小三角形的三种物质中至少含有一种相同元素;
②D为固体单质,O为气体单质,其余物质为常见化合物;
③C能使品红溶液褪色,也能使澄清的石灰水变浑浊;
④E为淡黄色化合物,与L反应生成O;
⑤L和J的水溶液可生成K;
⑥H是红棕色气体,可形成酸雨。
请回答下列问题:
(1)E的电子式为__,结构中含有__(填“离子键”、“极性键”、“非极性键”),写出E→F的离子反应方程式___。
(2)K的化学式为__,写出L和J的水溶液生成K的化学方程式___。
(3)I的浓溶液具有强__性(填“氧化”、“还原”),该浓溶液与C反应的化学方程式为__。
(4)A与C具有相同的元素组成,则A的化学式为__,写出C转化为A的化学反应方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com