
【题目】在1 L密闭容器中,把1mol A和1 mol B混合发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A.x的值为2B.A的转化率为40%
C.B的平衡浓度为0.8 mol/LD.D的体积分数为20%
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
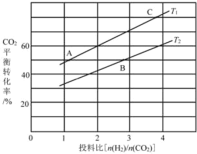
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
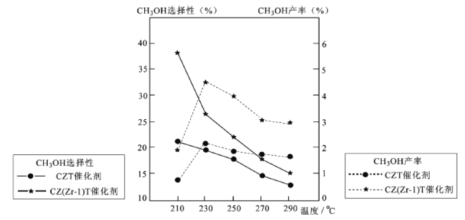
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下合成路线,甲经二步转化为丙:
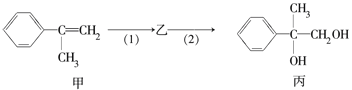
下列叙述错误的是
A. 甲和丙均可与酸性KMnO4溶液发生反应
B. 反应(1)的无机试剂是液溴,铁作催化剂
C. 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D. 反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
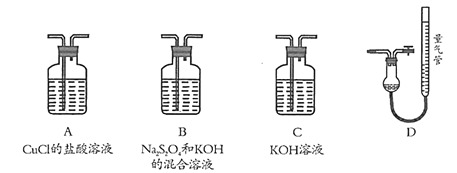
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠呦呦,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图)。下列说法正确的是

A.异胡薄荷醇的分子式为C10H17O
B.异胡薄荷醇在NaOH醇溶液中可发生消去反应
C.青蒿素分子中含有7个手性碳原子
D.青蒿素在热的酸、碱溶液中均可稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在日常生活中有广泛应用。漂白液通常用于家庭和公共场所的消毒,某品牌漂白液的包装说明如下:

(1)该漂白液中,NaClO的物质的量浓度约为___ mol·L-1。
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式___,制取500mL此漂白液,需要5.0mol·L-1的NaOH溶液___mL。
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲苯生产一种常用的化妆品防霉剂,其生产过程如图所示![]() 反应条件没有全部注明
反应条件没有全部注明![]() 。
。
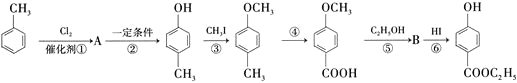
回答下列问题。
(1)有机物A的结构简式为_____________。
(2)在合成路线中,设计第③步反应的目的是_________________________________。
(3)写出反应⑤的化学方程式:__________________________________。
(4)请写出由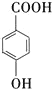 生成
生成![]() 的化学反应方程式:_________________。
的化学反应方程式:_________________。
(5)下列有关说法正确的有_________![]() 填序号
填序号![]() 。
。
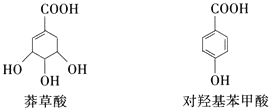
![]() 莽草酸、对羟基苯甲酸都属于芳香化合物
莽草酸、对羟基苯甲酸都属于芳香化合物
![]() 莽草酸与NaOH溶液反应,最多消耗
莽草酸与NaOH溶液反应,最多消耗![]()
![]() 二者均可以发生酯化、加成等反应
二者均可以发生酯化、加成等反应
![]() 利用
利用![]() 溶液可区别莽草酸和对羟基苯甲酸
溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的 的所有同分异构体的结构简式:_________ 、________。
的所有同分异构体的结构简式:_________ 、________。
a. 含苯环 ![]() 可与
可与![]() 溶液发生显色反应 c. 苯环上一氯代物有两种
溶液发生显色反应 c. 苯环上一氯代物有两种 ![]() 能发生银镜反应,不能发生水解反应
能发生银镜反应,不能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2![]() CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如图1所示:
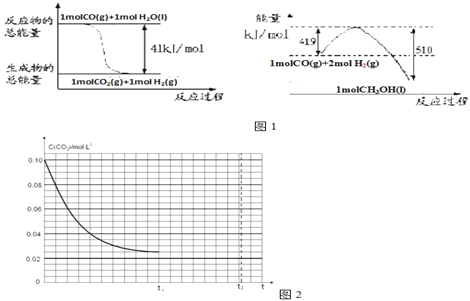
写出由二氧化碳和氢气制备甲醇的热化学方程式______________________________,该反应的△S_______0(填“>”或“<”或“=”),在________情况下有利于该反应自发进行(填“低温”或“高温”)。
(2)如果上述反应方程式的平衡常数K值变大,则该反应_________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)若反应容器的容积为2.0L,CO2和H2的起始浓度分别为0.10 mol·L-1和0.30 mol·L-1。
①若反应时间为4.0min,容器内气体的密度减少了2.0g/L,则在这段时间内CO2的平均反应速率为__________。
②若反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线如图2所示.保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com