
����Ŀ����ҵ�Ͽ������÷����е�CO2Ϊԭ����ȡ�״����䷴Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺
��1����֪���³�ѹ�����з�Ӧ�������仯��ͼ1��ʾ��
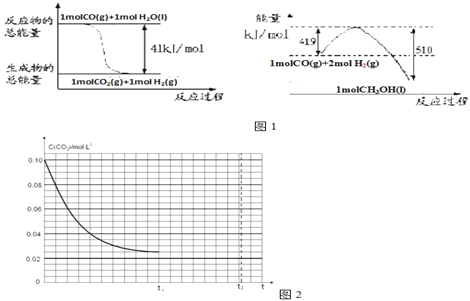
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ______________________________���÷�Ӧ�ġ�S_______0�������������=��������________����������ڸ÷�Ӧ�Է����У�����¡����¡�����
��2�����������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����÷�Ӧ_________��ѡ���ţ���
A��һ��������Ӧ�����ƶ� B����ƽ���ƶ�ʱ����Ӧ������������С
C��һ�����淴Ӧ�����ƶ� D����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
��3������Ӧ�������ݻ�Ϊ2.0L��CO2��H2����ʼŨ�ȷֱ�Ϊ0.10 mol��L-1��0.30 mol��L-1��
������Ӧʱ��Ϊ4.0min��������������ܶȼ�����2.0g/L���������ʱ����CO2��ƽ����Ӧ����Ϊ__________��
������Ӧ��t1ʱ�ﵽƽ�⣬������c��CO2����ʱ��t�仯����������ͼ2��ʾ�����������������䣬t1ʱ���������ѹ����1L���뻭��t1��c��CO2����ʱ��t�仯�������ߣ�t2�ﵽ�µ�ƽ�⣩______________��
���𰸡�3H2(g) + CO2(g)��CH3OH(l)+ H2O(l) ��H=��50kJ/mol �� ���� AD 0.01mol/(L��min) 
��������
��1����������ɵ��Ȼ�ѧ����ʽ����CO(g)+H2O(l)=CO2(g)+H2(g) ��H=��41kJ/mol����CO(g) +H2(g)=CH3OH(l)��H=��91kJ/mol�����ݸ�˹���ɣ��ɢڣ��٣������ɵ�3H2(g) + CO2(g)=CH3OH(l)+ H2O(l)��H=��50kJ/mol���ɷ���ʽ��֪���÷�Ӧ��һ����ϵ�Ļ��ҳ̶ȼ�С�ķ�Ӧ�����ԡ�S��0�����ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ�ڵ�������������ڸ÷�Ӧ�Է����У�
��2�����ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����ƽ�������ƶ�������Kֻ���¶��йأ�����ѹǿ��Ũ�ȵ��أ�����ֻ���¶Ƚ��Ͳſ�������������������ʱ��V����V������С��V����С�Ķ࣬V����V����ƽ�������ƶ����淴Ӧ�����ȼ�С�����������ӡ���ѡAD��
��3���ٷ�Ӧ�������ݻ�Ϊ2.0L��������������ܶȼ�����2.0g/L�������������������2.0g/L��2.0L=4.0g�����м��ٵ�CO2������Ϊ4��![]() =3.52g��������n(CO2)=
=3.52g��������n(CO2)=![]() =
=![]() =0.08mol�����V(CO2)=
=0.08mol�����V(CO2)= ![]() =
=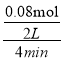 = 0.01mol/(L��min)��
= 0.01mol/(L��min)��
�ڵ����������������䣬t1ʱ���������ѹ����1L��˲�������̼Ũ�ȡ���������Ϊc(CO2)=0.05mol/L��c(H2)=0.15mol/L��ƽ�������ƶ���������c(CO2)=xmol/L��������c(H2)=3xmol/L��ƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CO2)=(0.05-x)mol/L��c(H2)=(0.15-3x)mol/L��ƽ�ⳣ�����䡣��![]() =
=![]() �����x=0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L����t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ
�����x=0.025mol/L����t2�ﵽ�µ�ƽ��ʱc(CO2)=0.025mol/L����t1��c(CO2)��ʱ��t�仯��������Ϊ��ͼ��ʾ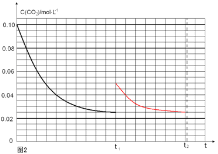 ��
��


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L�ܱ������У���1mol A��1 mol B��Ϸ������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
A.x��ֵΪ2B.A��ת����Ϊ40%
C.B��ƽ��Ũ��Ϊ0.8 mol/LD.D���������Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ��㶨���ܱ������У��������¿��淴Ӧ��A(s)+2B(g)![]() C(g)+D(g)�����������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
C(g)+D(g)�����������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
�ٻ��������ܶȲ��ٱ仯ʱ���������������ѹǿ���ٱ仯ʱ���ۻ������������ʵ������ٱ仯ʱ����B�����ʵ���Ũ�Ȳ��ٱ仯ʱ���ݻ�������ƽ����Է����������ٱ仯ʱ����v��(B)=2v��(C)ʱ
A. �٢ܢݢ�B. �ڢۢ�C. �ڢܢݢ�D. ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һЩ����֮�������ͼ��ʾ�����ǹ�ϵ��
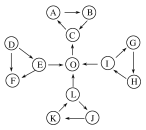
��ͼ��ÿ��С�����ε��������������ٺ���һ����ͬԪ�أ�
��DΪ���嵥�ʣ�OΪ���嵥�ʣ���������Ϊ���������
��C��ʹƷ����Һ��ɫ��Ҳ��ʹ�����ʯ��ˮ����ǣ�
��EΪ����ɫ�������L��Ӧ����O��
��L��J��ˮ��Һ������K��
��H�Ǻ���ɫ���壬���γ����ꡣ
��ش��������⣺
��1��E�ĵ���ʽΪ__���ṹ�к���__���������Ӽ����������Լ��������Ǽ��Լ�������д��E��F�����ӷ�Ӧ����ʽ___��
��2��K�Ļ�ѧʽΪ__��д��L��J��ˮ��Һ����K�Ļ�ѧ����ʽ___��
��3��I��Ũ��Һ����ǿ__�ԣ�����������������ԭ��������Ũ��Һ��C��Ӧ�Ļ�ѧ����ʽΪ__��
��4��A��C������ͬ��Ԫ����ɣ���A�Ļ�ѧʽΪ__��д��Cת��ΪA�Ļ�ѧ��Ӧ����ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ����ϩ������Ҫ�Ļ���ԭ�ϡ��ش��������⣺
��1��1902�꣬Sabatier�״η��֣���ѹ�¹��ɽ������Դ�����˫������������̬���ļ��ⷴӦ��
����֪��C2H2��g����H2��g���TC2H4��g����H1=-174.3kJ��mol��1
K1��300K��=3.37��1024
C2H2��g����2H2��g��=C2H6��g����H2�T-311.0kJ��molһl
K2��300K���T1.19��1042
��ӦC2H4��g����H2��g���TC2H6��g���ġ�H=___kJ��molһ1��K��300K��=__��������λ��Ч���֣���
��2010��Sheth�ȵó���Ȳ��Pd����ѡ�����ķ�Ӧ��������ͼ��������������Pd�����ϵ�������*��ע��
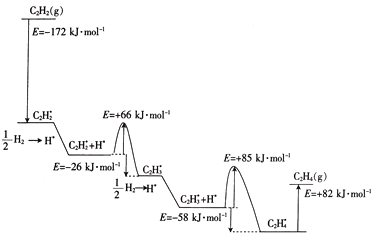
����������ӦΪ____������ȡ������ȡ�����Ӧ����������������ݣ���ܣ�Ϊ____kJ��mol-1���ò���Ļ�ѧ����ʽΪ____��
��2���ں����ܱ������г�����ϩ��һ�������·�����ӦC2H4��g��C2H2��g����H2��g������ϩ�������Ϊa��ƽ��ʱ������������ѹǿΪP�������ѹp��C2H4���T___����p����a��ʾ����
��3������ͼװ�õ�⺬CO2��ij���Է�ˮ��Һ�����������к�����ϩ��
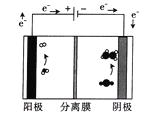
�÷���ĤΪ___�������������������ѡ���Խ���Ĥ��������ϩ�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�Ϊ![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ��
��![]() �ļ���Һ��50mL���
�ļ���Һ��50mL���![]() ����Һ���ܶȾ�Ϊ
����Һ���ܶȾ�Ϊ![]() ��������Ϊ
��������Ϊ![]() �������������������Һ���¶ȱ仯�������£�
�������������������Һ���¶ȱ仯�������£�
��Ӧ�� | ��ʼ�¶� | ��ֹ�¶� |
| 20 |
|
| 20 |
|
��Ӧ![]() ���ʱ�ԼΪ(��λ��
���ʱ�ԼΪ(��λ��![]() )
)
A.![]() B.
B.![]()
C.![]() D.ȱ�����ݣ�������
D.ȱ�����ݣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ��H=��190kJ/mol������˵����ȷ����
O2(g)=CO2(g)+2H2(g) ��H=��190kJ/mol������˵����ȷ����
A.CH3OH��ȼ����Ϊ190kJ/mol
B.�÷�Ӧ˵��CH3OH��H2�ȶ�
C.��Ӧ�е������仯�뷴Ӧ��ϵ���¶Ⱥ�ѹǿ��
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ��H=+190kJ/mol
O2(g) ��H=+190kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɱ���ܱ�������ʢ��������A��B�Ļ�����壬��һ�������·�����Ӧ��A+3B![]() 2C��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV��������C��������ռ10%�������ƶ���ȷ���ǣ� ��
2C��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV��������C��������ռ10%�������ƶ���ȷ���ǣ� ��
��ԭ�����������Ϊ1.2V����
��ԭ�����������Ϊ1.1V����
�۷�Ӧ��ƽ��ʱ����A���ĵ�0.05V����
�ܷ�Ӧ��ƽ��ʱ����B���ĵ�0.05V����
A.�ڢ�B.�ڢ�C.�٢�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ij��������X���������ֳ���Ԫ�أ�����ɣ���Ʋ��������ʵ�飨�����в�����������ȥ����
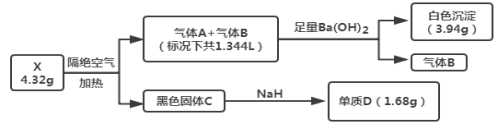
��֪������A������B����Ԫ����ͬ��������ɫ��ζ���壬����CΪ�������Ҿ��д��ԣ�����D��Ŀǰ������ҵӦ����㷺�Ľ�����
����������Ϣ���ش��������⣺
��1����X�Ļ�ѧʽΪ____��B�Ļ�ѧʽΪ____��
��2����ˮ�����£�����NaH���������C��Ӧ���ų��������ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ��____��
��3��������������Aȫ����100mL0.35mol��L-1����������Һ������գ���Ӧ�������ӷ���ʽΪ____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com