
����Ŀ��Ϊ̽��ij��������X���������ֳ���Ԫ�أ�����ɣ���Ʋ��������ʵ�飨�����в�����������ȥ����
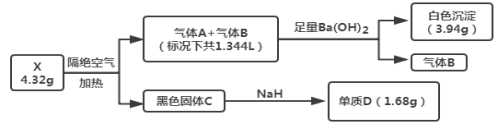
��֪������A������B����Ԫ����ͬ��������ɫ��ζ���壬����CΪ�������Ҿ��д��ԣ�����D��Ŀǰ������ҵӦ����㷺�Ľ�����
����������Ϣ���ش��������⣺
��1����X�Ļ�ѧʽΪ____��B�Ļ�ѧʽΪ____��
��2����ˮ�����£�����NaH���������C��Ӧ���ų��������ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ��____��
��3��������������Aȫ����100mL0.35mol��L-1����������Һ������գ���Ӧ�������ӷ���ʽΪ____��
���𰸡�FeC2O4 CO Fe3O4+4NaH=3Fe+4NaOH ![]() ��
��![]()
��������
����AΪ�������Ҿ��д��ԣ�����D��Ŀǰ������ҵӦ����㷺�Ľ�������D��NaH��Ӧ����D����DΪFe��CΪFe3O4������A������B����Ԫ����ͬ��������ɫ��ζ���壬�ҽ���������ͨ������Ba(OH)2��Һ�У�������ɫ������B����Ӧ����AΪCO2��BΪCO��D������Ϊ1.68g����4.32gX��Fe�����ʵ���Ϊ0.03mol�����ȷֽ����0.01molFe3O4����ɫ����BaCO3������Ϊ3.94g�������̼Ԫ���غ��֪��n(CO2)=![]() =0.02mol��X���ȷֽ������CO��CO2�����Ϊ1.344L(���)����n(CO)+n(CO2)=
=0.02mol��X���ȷֽ������CO��CO2�����Ϊ1.344L(���)����n(CO)+n(CO2)=![]() =0.06mol����n(CO)=0.04mol������������4.32gX�������������ȷֽ����0.01molFe3O4��0.02molCO2��0.04molCO����4.32gX��0.03molFe��0.06molC��0.12molO����X�Ļ�ѧʽΪFeC2O4��
=0.06mol����n(CO)=0.04mol������������4.32gX�������������ȷֽ����0.01molFe3O4��0.02molCO2��0.04molCO����4.32gX��0.03molFe��0.06molC��0.12molO����X�Ļ�ѧʽΪFeC2O4��
��1��������������֪��XΪFeC2O4��B�Ļ�ѧʽΪCO��
��2��������ɵ���Ϣ�������Ƴ��÷�Ӧ�Ļ�ѧ����ʽΪ��Fe3O4+4NaH=3Fe+4NaOH��
��3��������������A�����ʵ���Ϊ0.02mol��n(NaOH)=0.1L��0.35mol/L=0.035mol��
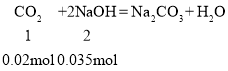
��CO2�������������漰������ѧ��Ӧ��![]() ��
��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ������÷����е�CO2Ϊԭ����ȡ�״����䷴Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺
��1����֪���³�ѹ�����з�Ӧ�������仯��ͼ1��ʾ��
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ______________________________���÷�Ӧ�ġ�S_______0�������������=��������________����������ڸ÷�Ӧ�Է����У�����¡����¡�����
��2�����������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����÷�Ӧ_________��ѡ���ţ���
A��һ��������Ӧ�����ƶ� B����ƽ���ƶ�ʱ����Ӧ������������С
C��һ�����淴Ӧ�����ƶ� D����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
��3������Ӧ�������ݻ�Ϊ2.0L��CO2��H2����ʼŨ�ȷֱ�Ϊ0.10 mol��L-1��0.30 mol��L-1��
������Ӧʱ��Ϊ4.0min��������������ܶȼ�����2.0g/L���������ʱ����CO2��ƽ����Ӧ����Ϊ__________��
������Ӧ��t1ʱ�ﵽƽ�⣬������c��CO2����ʱ��t�仯����������ͼ2��ʾ�����������������䣬t1ʱ���������ѹ����1L���뻭��t1��c��CO2����ʱ��t�仯�������ߣ�t2�ﵽ�µ�ƽ�⣩______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2012����ͨ����]��12�֣���ʽ������[Fe(OH)SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ����������£�
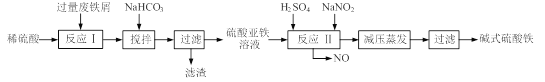 ��֪������������������������ʽ����ʱ��Һ��pH���±���
��֪������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
�ش��������⣺
��1����������NaHCO3��Ŀ���ǵ���pH��ʹ��Һ�е� �������ù��������������������� ��
��2����ʵ�������У���Ӧ����ͬʱͨ��O2�Լ���NaNO2��������O2��NaNO2�ڷ�Ӧ�о��� �������뷴Ӧ��O2��11.2L����״���������൱�ڽ�ԼNaNO2�����ʵ���Ϊ ��
��3����ʽ����������ˮ�������Fe(OH)2+���ӣ��ɲ���ˮ������Fe2(OH)42+�ۺ����ӡ���ˮ�ⷴӦ�����ӷ���ʽΪ ��
��4����ҽҩ�ϳ����������������ᡢ����Ļ��Һ��Ӧ�Ʊ���ʽ�������������ҹ�����������Ʒ�в��ú���Fe2+��NO3����Ϊ�������ò�Ʒ���Ƿ���Fe2+��Ӧʹ�õ��Լ�Ϊ ��
A����ˮ B��KSCN��Һ C��NaOH��Һ D������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȡ����Ӧ����
��CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
��CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
��CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
��C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. �٢�B. �ۢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�㶼���и��������������ܶȵ��ص㡣�������ȵ�������͵���е�һƥ��������ṹ��ͼ��ʾ������˵����ȷ����

A. ͼʾ������������Ӧ�ķ������ƶ�������(B)
B. ��طŵ�����У���ת��1mol���ӣ���M�缫������С12g
C. ��س������������ĵ缫��ӦʽΪ��B+3F����3e��=BiF3
D. �õ����Ҫ�ڸ��������¹�����Ŀ���ǽ�����ת��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����amol���ۼ��뵽��bmol������Һ�У���ַ�Ӧ��������ȫ�ܽ⣬���ռ���c L���������NO��NO2������塣�����й�˵������ȷ����
A. ����Ӧ�������ֻ��Fe2+���ɣ���![]() < a<
< a<![]()
B. ����Ӧ�������ֻ��Fe3+���ɣ���b=3a +![]()
C. ����Ӧ���������Fe2+��Fe3+���ɣ���![]() <b<6a
<b<6a
D. ����Ӧ����Һ����dmol H+����b=3a+d+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ��ʱ�ķ�Ӧ�Ƚ��������ʵ���ֵ������������ת��ͼ������˵������ȷ���ǣ�������

A.ת������Ȼ�ѧ����ʽΪ��C��s����O2��g��=CO2��g������H����393.5 kJ��mol��1
B.ת������Ȼ�ѧ����ʽΪ��2CO��g����O2��g��=2CO2��g������H����565.8 kJ��mol��1
C.��C��CO���Ȼ�ѧ����ʽΪ��2C��s����O2��g��=2CO��g������H����110.6 kJ��mol��1
D.CO����ֵ����H����10.1 kJ��g��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
��������0.50mol/L NaOH��Һ
��1����ʵ���д�ԼҪʹ��245mL NaOH��Һ��������Ҫ����NaOH����______g��
��2�����±���ѡ�����NaOH��������Ҫ�������ǣ�����ĸ����____��
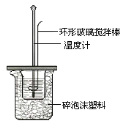
�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3kJ/mol����_____��
��2��ȡ50mL NaOH��Һ��30mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
�¶� ʵ�� ���� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
��������Ϊ0.50mol/L NaOH��Һ��0.50mol/L������Һ���ܶȶ���1g/cm3���кͺ�������Һ�ı�����c=4.18J/(g����)�����к�����H=___��ȡС�����һλ����
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ������ǣ�����ĸ��________��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӹ�ҵ�У�����FeCl3��HCl��Һ��Ϊӡˢ��·ͭ���ʴҺ��ij̽��С�����������·������Һ����Դ���գ�
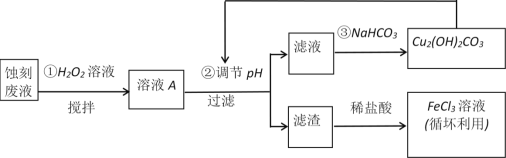
��ش�
(1)��FeCl3��Һ���ɡ����գ����õ�����Ҫ���������____________��
(2)FeCl3ʴ��Һ�м��������Ŀ����______________________________��
(3)������м���H2O2��Һ��Ŀ����(�����ӷ���ʽ��ʾ)_____________________��
(4)��֪�������������������pH���±�
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 4.7 | 7.0 | 1.9 |
������ȫʱ | 6.7 | 9.0 | 3.2 |
���ݱ��������Ʋ����pH�ķ�Χ��________________��
(5)��������·���У���FeCl3��Һ�⣬��������ѭ�����õ�������__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com