
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式______,核外电子占据最高能级的电子云形状为______;基态As原子最高能层上有______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为______和+3,砷的第一电离能比镓______(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为______。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为______,AsH3分子的空间构型为______。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为______。
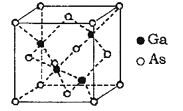
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以______(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm则GaAs晶体的密度为______gcm-3(列出计算式即可)。
【答案】4s24p1 哑铃型 3 +1 大 V、Co sp3 三角锥形 大于 NH3分子之间含氢键 共价键 ρ=![]()
【解析】
(1)Ga是31号元素,基态Ga原子价电子排布式为4s24p1,核外电子占据最高能级的电子云形状为哑铃型,As为33号元素,基态As原子最高能层上有3个电子,故答案为:4s24p1;哑铃型;3;
(2)根据镓的电离能数值可知,失去1个电子或3个电子时电离能突变,由此可推知镓的主要化合价为+1和+3,砷的4p上有3个电子,为半充满状态,所以砷第一电离能比镓大,故答案为:+1;大;
(3)As原子核外有3个未成对电子,在第四周期中,与之相同的元素符为V,其价电子排布式为3d34s2和Co,其价电子排布式为3d74s2,故答案为:V、Co;
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的价层电子对数为4,杂化方式为sp3,由于As和N同主族,化学性质相似,所以NH3是三角锥形,AsH3也是三角锥形,故答案为:sp3;三角锥形;
(5)As和N同主族,相同压强下,AsH3的沸点小于NH3的沸点,因为NH3分子之间含氢键,沸点反常高于同主族的氢化物的沸点,故答案为:大于;NH3分子之间含氢键;
(6)GaAs为原子晶体,Ga与As以共价键键合,该晶胞中Ga原子个数为4,As原子个数为8×1/8+6×1/2=4,该晶胞的密度为ρ=![]() =
=![]() ,故答案为:共价键;ρ=
,故答案为:共价键;ρ=![]() 。
。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关系正确的是()
A.熔点:正戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>H2O>苯
C.同质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D.同物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应中的能量变化,下列说法中不正确的是( )
A. 燃烧反应都是放热反应
B. 对于可逆反应:aA(g)+bB(g)![]() bC(g)+dD(g),如果正反应放热,逆反应一定吸热
bC(g)+dD(g),如果正反应放热,逆反应一定吸热
C. 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量
D. 只有放热的氧化还原反应才可以设计为原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆方向移动B.Y可能是固体或液体
C.系数n>mD.Z的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液_____________________、_______________________、过滤、洗涤干燥得FeCl3·6H2O;再______________________________,得到无水FeCl3。
(2)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=______mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(3)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
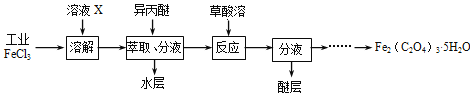
①为抑制FeCl3水解,溶液X为______________。
②所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是____________________________。
③为测定所得草酸铁晶体的纯度,实验室称取ag样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_________(填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是___________。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)= 2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是___________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应。
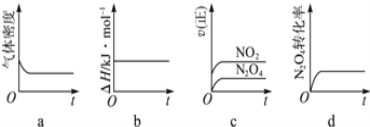
(3)一定温度下,反应(Ⅱ)的焓变为△H。现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________。若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”)。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是______________(用离子方程式表示)。向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______molL﹣1 。(NH3H2O的电离平衡常数取Kb=2×10﹣5molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
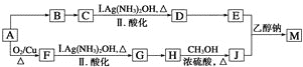
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
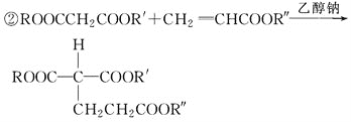
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是4.94g
B.ClO-的生成是由于温度升高引起的
C.氧化性ClO-<ClO3-
D.反应中转移电子的物质的量是0.21mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com