
����Ŀ��ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��(CH3)2NNH2(l)+2N2O4(l)= 2CO2(g)+3N2(g)+4H2O(g) (��)
(1)��Ӧ(��)����������___________��
(2)����к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4(g)2NO2(g) (��)���¶�����ʱ��������ɫ�����Ӧ(��)Ϊ______(��������������������)��Ӧ��
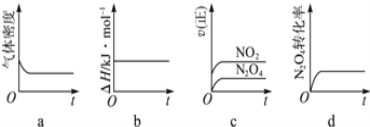
(3)һ���¶��£���Ӧ(��)���ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����_________��������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��______(������������������������С��)��
(4)NO2���ð�ˮ��������NH4NO3 ��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ����______________(�����ӷ���ʽ��ʾ)�������Һ�μ�b L ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫________(��������������������������)�ƶ������μӰ�ˮ��Ũ��Ϊ_______molL��1 ��(NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5molL��1)
���𰸡�N2O4 ���� ad ���� NH4++H2ONH3H2O+H+ ���� a/200b
��������
��1�����ݻ��ϼ۵ı仯���������ϼ۽��͵�������������ԭ��
��2�����¶�����ʱ��������ɫ���˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
��3����ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�
��4������笠�����ˮ������ش�����ͬ����ЧӦ��һˮ�ϰ���笠�����ˮ�����������ã�����һˮ�ϰ��ĵ���ƽ�ⳣ������õ���ˮŨ�ȣ�
����1����Ӧ�������У�N2O4��l����NԪ�صõ��ӻ��ϼ۽��ͣ�N2O4��l��������������CH3��2NNH2��l����CԪ�غ�NԪ�ػ��ϼ����ߣ��ǻ�ԭ����
�ʴ�Ϊ��N2O4��
��2��N2O4��g��2NO2��g�� �����������¶�����ʱ��������ɫ���˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��һ���¶��£���Ӧ���������ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�
a���ܶȵ����������������ƽ����ϵ�������䣬��Ӧ��������ܶ��ڷ�Ӧ�����м�С���ܶȲ���˵����Ӧ�ﵽƽ�⣬��a���ϣ�
b����Ӧ���ʱ�ͷ�Ӧ���������������ܺ�֮����㣬��ƽ���أ���b�����ϣ�
c��ͼ��ֻ��ʾ����Ӧ���ʱ仯������֤�����淴Ӧ������ͬ����c�����ϣ�
d��N2O4��l��ת���ʲ��䣬֤����Ӧ�ﵽƽ�⣬��d���ϣ�
ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����ad����ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����ƽ�ⳣ��K���䣻
�ʴ�Ϊ��ad�����䣻
NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�����Ϊ笠�����ˮ�⣻��Ӧ�����ӷ���ʽΪ��NH4++H2ONH3H2O+H+�����백ˮ��Һ����笠�����ˮ�⣬ƽ��������У���a mol NH4NO3����ˮ�������Һ�μ�b L ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10-7mol/L��c��NH4+��=c��NO3-����NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5 molL-1�����Ϻ���Һ���Ϊ1L��c��NH4+��=c��NO3-��=amol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH-��ƽ�ⳣ��K= ==2��10-5 molL-1������õ�c��NH3H2O��= a/200bmol/L��
==2��10-5 molL-1������õ�c��NH3H2O��= a/200bmol/L��
�ʴ�Ϊ��NH4++H2ONH3H2O+H+������a/200b��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����PCl3����һ����Ҫ���л��ϳɴ�����ʵ���ҳ��ú���������Cl2��ȡPCl3��װ����ͼ��ʾ��

��֪�� PCl3�۵�Ϊ��112�����е�Ϊ75.5�����ױ���������ˮ��ˮ�⡣��Cl2��Ӧ����PCl5��
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ__________________��
��2��B����װ�Լ�������___________________��E�м�ʯ�ҵ�������___________________��
��3��ʵ��ʱ�����װ�������Ժ���Cװ�õ�������м�����ף���ֹˮ��Kͨ������CO2��һ��ʱ��ر�K��������������ϲ��л�ɫ���������ʱͨ����������Ӧ�������С�ͨ����CO2��������____________________��CO2______��ѡ����������������������Cl2���棬������________________��
��4��D���ձ���ʢװ__________����������_______________��
��5��PCl3ˮ��õ������ᣨ����ʽ��H3PO3����Ԫ���ᣩ��д���������Ʊ�Ũ�������������ӷ���ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���ͬ�������ܱ�����M��N���������¶�Ϊ150 ��,��M�����м���a mol HI��ͬʱ��N�����м���b mol HI (a>b)������Ӧ2HI(g)![]() H2 (g) + I2 (g) �ﵽƽ���������˵����ȷ����
H2 (g) + I2 (g) �ﵽƽ���������˵����ȷ����
A���ӷ�Ӧ��ʼ���ﵽƽ��,����ʱ��tM > tN
B��ƽ��ʱcM(I2) = c N(I2)
C��ƽ��ʱI2 �����ڻ�������е����������M > N
D��HI��ƽ��ֽ�����M = ��N
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
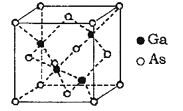
����Ŀ��2019��1��3�����磬�϶��ĺ�̽������Ȼ���£��״�ʵ������������������������½�������ص������ö���������ͨ���黯�أ�GaAs��̫���ܵ���ṩ�������й������ش��������⣺
��1����̬Gaԭ�Ӽ۵����Ų�ʽ______���������ռ������ܼ��ĵ�������״Ϊ______����̬Asԭ������ܲ�����______�����ӡ�
��2����ʧȥ���ӵ������ܣ���λ��kJmol-1������ֵ����Ϊ577��1985��2962��6192���ɴ˿���֪�ص���Ҫ���ϼ�Ϊ______��+3����ĵ�һ�����ܱ���______��������������С������
��3����������Ԫ���У����̬Asԭ�Ӻ���δ�ɶԵ�����Ŀ��ͬ��Ԫ�ط���Ϊ______��
��4���黯�ؿ��ɣ�CH3��3Ga��AsH3��700���Ƶã���CH3��3Ga��Cԭ�ӵ��ӻ���ʽΪ______��AsH3���ӵĿռ乹��Ϊ______��
��5����ͬѹǿ�£�AsH3�ķе�______NH3����������������С��������ԭ��Ϊ______��
��6��GaAsΪԭ�Ӿ��壬�侧���ṹ��ͼ��ʾ��Ga��As��______���������ۼ����������Ӽ��������ϡ��谢��٤��������ֵΪNA���þ����߳�Ϊa pm��GaAs������ܶ�Ϊ______gcm-3���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A. ����������Һ�м�������泥�Ba2����OH����NH4+��SO42-=BaSO4����NH3��H2O
B. �ö��Ե缫���CuCl2��Һ��Cu2����2Cl����2H2O![]() Cu(OH)2����H2����Cl2��
Cu(OH)2����H2����Cl2��
C. ��Ư����Һ��ͨ��������������Ca2����2ClO����SO2��H2O=CaSO3����2HClO
D. ������Һ��ͨ��������CO2��C6H5O����CO2��H2O��C6H5OH��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ϵͳ�У���ʼ�¶�Ϊ25�棬��20.00mL0.1000mol/L�İ�ˮ��Һ����μ���0.1000mol/L��HCl��Һ����û����Һ���¶ȱ仯��ͼ���������˵����ȷ����
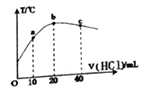
A. a��b��c���ˮ�ĵ���̶���������
B. �ж���Һ��pH:b��pH=7��c��pH<7
C. ��֪25��ʱ0.2mol/L��ˮ�����Ϊ1.33%����ʱ��ˮ��pH ԼΪ12
D. ��a����Һ�ʼ��ԣ���a����c(NH4+)>c(Cl-)>c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧԭ����Ӧ�ã�����ȷ���ǣ� ��
A.Al3++3H2O![]() Al(OH)3+3H+ ������ˮ
Al(OH)3+3H+ ������ˮ
B.�û�ѧƽ���ƶ�ԭ���ܽ��ͼӴ�����ʹN2��H2��һ��������ת��ΪNH3
C.TiCl4��(x��2)H2O��������![]() TiO2��xH2O����4HCl �Ʊ�TiO2��ĩ
TiO2��xH2O����4HCl �Ʊ�TiO2��ĩ
D.CO32-��H2O![]() HCO3-��OH-���ȵļ���Һ��ϴ����
HCO3-��OH-���ȵļ���Һ��ϴ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ຬ���ڻ���ͭ(Cu2Te)������������(Cr2O3)�Լ�������ȣ�ijС�����������Դ�ۺ����õķ�����

��֪���ں���λ��ͬ���壬����ʱCu2Te�����ķ�ӦΪCu2Te+2O2![]() 2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
����˵���������
A. �������������������ʱͭ���ں�Ԫ�ض�������
B. ���ữ��ʱ������Һ�м�������
C. ������1������Ҫ�ɷ�ΪCu
D. ����Һ3������ѭ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com