
【题目】下列对于“摩尔”的理解正确的是
A.属于七种基本物理量之一B.是物质的量的单位,符号为mol
C.12g碳所含有的原子数目为1摩尔D.只能用来计量纯净物,不能用于混合物
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。某化学兴趣小组在实验室中对Cl2与FeCl2和KSCN混合溶液的反应进行了探究。回答下列问题:
(1)Cl2为制备
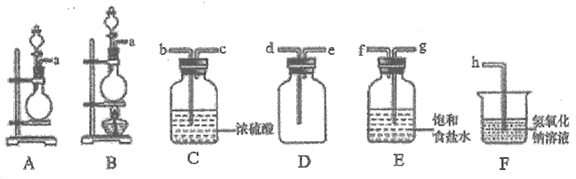
①该小组同学选用KMnO4固体和浓盐酸混合快速制备Cl2,气体发生装置应选择__(填大写字母),该反应的离子方程式为___________。
②欲收集一瓶干燥纯净的氯气,选择上图中的装置,其连接顺序为a→________(按气流方向,用小写字母表示)。
(2)Cl2的性质实验
Cl2与FeCl2和KSCN混合溶液的反应,随着Cl2不断通入,A装置中溶液先变红,后逐渐褪色。
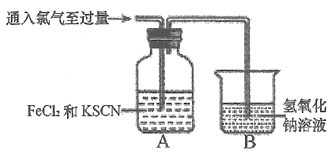
①装置B中发生反应的离子方程式为___________。
②装置A中溶液变红的原因是_________(用离子方程式表示)。
(3)后续实验探究
为了探究上图A装置中溶液红色褪去的原因,该小组取少量A中褪色后的溶液,向其中加入_____(填化学式)后,溶液逐渐恢复为红色,由此得出结论:SCN-被Cl2氧化。
为了探究SCN-被Cl2氧化氧化后的产,该小组又做了如下探究:
①查阅资料,发现SCN-中氮元素为-3价、碳元素为+4价。
②取A中褪色后的溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
③通过实验证明了SCN-中氮元素转化为NO3-。
请结合以上实验探究结果写出SCN-与Cl2反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y的反应不可能是( )
A.盐和盐的反应B.碱性氧化物和水的反应
C.酸与碱的反应D.酸性氧化物和碱的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:____,还需要的玻璃仪器有:____。
(2)粗盐中含有Ca2+、 Mg2+、 SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为____(填写序号),最后在滤液加入盐酸至溶液呈中性。请写出加入盐酸后可能发生反应的离子方程式:____。
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:____。
(4)电解无水氯化镁制取镁的化学方程式为____。将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中,说法不正确的是
A.75.77%表示35Cl的质量分数B.24.23%表示37Cl的丰度
C.35. 453表示氯元素的相对原子质量D.36.966表示37Cl的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】求25℃时以下溶液的pH
(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH=
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH=
(3)pH=9的NaOH溶液稀释到原来的10倍后,pH= , 再稀释到原来的1000倍后,pH .
(4)pH=12的NaOH和pH=4的HCl等体积混合后,pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJmol﹣1 ,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=﹣657.01kJmol﹣1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=﹣625.63kJmol﹣1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
A.2.43×104 kJ
B.2.35×104 kJ
C.2.23×104 kJ
D.2.14×104 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐分类顺次排列的是( )
A. 硫酸(H2SO4)、纯碱(Na2CO3)、食盐(NaCl)
B. 硝酸(HNO3)、烧碱(NaOH)、胆矾(CuSO45H2O)
C. 醋酸(CH3COOH)、乙醇(C2H5OH)、硫酸铵[(NH4)2SO4]
D. 盐酸(HCl)、熟石灰[Ca(OH)2]、苛性钠(NaOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com