
【题目】将10 mL pH =1的CH3COOH 溶液加水稀释至100 mL后,溶液的pH为
A. 2 B. 2<pH<7 C. 1<pH<2 D. 无法判断
【答案】C
【解析】
CH3COOH为弱酸,加水稀释促进醋酸的电离,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L×![]() =0.01mol/L,以此解答。
=0.01mol/L,以此解答。
CH3COOH为弱酸,加水稀释促进醋酸的电离,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L×![]() =0.01mol/L,所以稀释后溶液的pH小于2,加水稀释氢离子浓度减小,则pH变大,所以稀释后溶液的pH>1,综上所述,稀释后的醋酸溶液:1<pH<2,答案选C。
=0.01mol/L,所以稀释后溶液的pH小于2,加水稀释氢离子浓度减小,则pH变大,所以稀释后溶液的pH>1,综上所述,稀释后的醋酸溶液:1<pH<2,答案选C。


科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。(提示:原子利用率=目标生成物的质量/参加反应的所有反应物的质量×100%),下列说法正确的是

A. ①→②吸收能量并形成了C―C键
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. 该催化剂可有效提高反应物的平衡转化率
D. 生成CH3COOH总反应的原子利用率小于100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
②既能提高反应速率,又能提高H2转化率的方法是___________(填序号)。
A.加入过量CO2气体 B.升高温度 C.适当压缩容器体积 D. 将CH3OCH3(g) 分离出去
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活生产中应用广泛,下列说法错误的是( )
A. 除夕夜色彩斑斓的烟火利用了金属的焰色反应
B. 减少汽车尾气的排放是控制酸雨危害的途径之一
C. 纯碱是钠的重要化合物之一,可用于治疗胃酸过多
D. 乙烯可以用来衡量一个国家的石油化工发展水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH为2的硫酸,下列叙述正确的是
A. c(H+)=c(SO42-)+c(OH-)
B. 与等体积pH=12的氨水混合后所得溶液显酸性
C. 由H2O电离出的c(H+)=1.0×10-12 mol·L-1
D. 与等体积0.01 mol·L-1的乙酸钠溶液混合后所得溶液中:c(SO42-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在化工生产、污水处理等领域应用广泛。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
b.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ/mol
H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:______。
(2)一定条件下,密闭容器中发生反应a,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是______(填字母)。

(3)反应b的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K正)的是______(填“A”或“B”)。

(4)T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和2molH2(g),发生反应b,则:COS的平衡转化率为______。
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:___________;___________。
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、______。
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废催化剂含有SiO2、ZnO、CuS、ZnS、Fe3O4等物质,为落实“节约资源,变废为宝”的环保理念,某课外兴趣小组的同学取20g该物质进行实验,回收其中的Cu和Zn,实验方案如下:
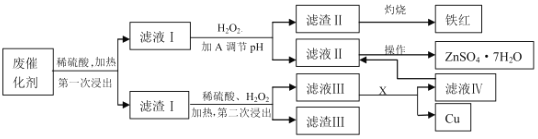
已知:ZnS可与稀硫酸反应;CuS不溶于稀硫酸,也不与其发生反应。请回答下列问题:
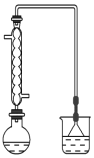
(1)可用图装置进行第一次浸出,烧杯中盛放的是______溶液。
(2)滤液Ⅰ中的Fe2+最好用______来检验。
a.氯水 b.双氧水 c.KSCN溶液 d.K3[Fe(CN)6]溶液
(3)物质A是含有X元素的氧化物(XO),则X是______(填元素符号),由滤液Ⅱ、Ⅳ滤液获得ZnSO47H2O的操作是______________。
(4)第二次浸出时的化学方程式为_______________。
(5)加A调节溶液的pH约为______时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于10-5mol/L时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了5.74gZnSO47H2O晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A是某粒子的结构示意图,B是铝元素在周期表中的信息。

(1)若A粒子带有两个单位的负电荷,且y等于8,则该粒子的符号为___。
(2)当x=17时,A元素和B元素形成的化合物的化学式为___。
(3)B元素的单质在空气中能生成致密的___(化学式)薄膜。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有某些相似的结构和性质。下列各组粒子中等电子体的是____(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43-和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的式量为( )
A. 100B. 90C. 88D. 80
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com