
中学化学中下列各物质间不能实现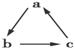 (“→”表示一步完成)转化的是 ( )
(“→”表示一步完成)转化的是 ( )
|
| A | B | C | D |
| a | CH3CH2OH | CH2===CH2 | Cl2 | C |
| b | CH3CHO | CH3CH2Br | HClO | CO |
| c | CH3COOH | CH3CH2OH | HCl | CO2 |
科目:高中化学 来源: 题型:
在三个密闭容器中分别充入Ne,H2,O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2) B.p(O2)> p(Ne)> p(H2)
C. p(H2)> p(O2)> p(Ne) D. p(H2)> p(Ne)> p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样
品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。
下图所示的是用燃烧法确定有机物分子式的常用装置。


现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧
后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是(装置不重复)



 D F;
D F;
(2)A、B管内均盛有固态试剂,A管的作用是
______________________________;
(3)该有机物的实验式为__________________;
(4)如果把CuO网去掉,A管重量将_________;(填“增大”、“减小”、或
“不变”)
(5)要确定该有机物的分子式,还必须知道的数据是___________。
① 消耗液体H2O2的质量 ②样品的摩尔质量 ③ CuO固体减少的质量 ④ C装置增加的质量 ⑤ 燃烧消耗O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化镁溶液的密度为1.18 g.cm-3,其中镁离子的质量分数为5.1%,300mL该溶液中 Cl-离子的物质的量约等于
A 0.37 mol B 1.5 mol C 0.74 mol D 0.63 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂肉为多,经测试,该化合物具有如下性质: ①1mol X与足量的金属钠反应产生1.5mol H2 ②X与醇(ROH)或羧酸(RCOOH)在浓H2SO4和加热条件下均可反应生成有香味的产物 ③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应。根据上述信息,下列对X的结构的判断正确的是:( )
A.X分子中肯定有碳碳双键 B. X分子中可能有三个羟基和一个-COOR官能团
C.X分子中可能有三个羧基 D. X分子中可能有一个羟基和二个羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃8mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为( )
A. 12.5% B. 25% C. 50% D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
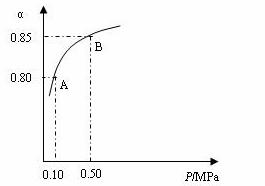
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
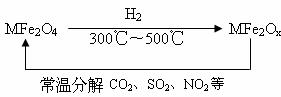
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下K sp(BaCO3)<K sp(BaSO3) |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得的气体是否为乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com