
判断下列原子(离子)的结构示意图是否正确,如有错,应如何改正?
磷原子![]() 碳原子
碳原子![]()
钠原子![]() 氧离子
氧离子![]()
科目:高中化学 来源: 题型:
(2011?丰台区二模)几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表中有关短周期元素性质的数据,判断下列说法不正确的是( )
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | He:-268.8 | Ne:-246 | Ar:-185.7 | Kr:-153.3 |
| ② | F2:-188.1 | Cl2:-34.6 | Br2:+58.8 | I2:+184 |
| ③ | NH3:-33 | PH3:-83 | AsH3:-55 | SbH3:-18.8 |
| ④ | H2O:+100 | H2S:-61 | H2Se:-41 | H2Te:-2 |
| ⑤ | HF:+20 | HCl:-85 | HBr:-67 | HI:-36 |
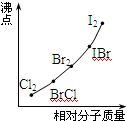
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com