
| A. | 氖元素的相对原子质量一定是12a/b | |
| B. | W g该氖原子的物质的量一定是W/(aNA)mol | |
| C. | 该氖原子的摩尔质量是aNA g | |
| D. | W g该氖原子所含的质子数是10 W/(aNA) |
分析 A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值;
B.已知质量求物质的量,运用公式n=$\frac{m}{M}$计算;
C.摩尔质量的单位为g/mol;
D.氖原子的质子数为10,1个氖原子所含的电子数是10个.
解答 解:A.元素是指具有相同核电荷数(核内质子数)的一类原子的总称.一种元素因中子数不同,有多种原子.元素的相对原子质量是指该元素的同位素按其丰度计算的平均值.氖原子的相对原子质量为$\frac{12a}{b}$,但该值不是氖元素的相对原子质量,故A错误;
B.根据公式n=$\frac{m}{M}$,一个该氖原子的质量是a,则1mol该氖原子的质量(摩尔质量)为(aNA)g/mol,那么Wg该氯原子的物质的量即为$\frac{W}{a{N}_{A}}$mol,故B正确;
C.一个该氖原子的质量是a,1mol该氖原子的质量(摩尔质量)为(aNA)g/mol,单位错误,故C错误;
D.一个该氖原子的质量是a,W g该氖原子个数Wg/ag.1个氖原子所含的电子数是10个. Wg该氖原子所含的电子数为$\frac{10W}{a}$,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化合物YR4中各原子均满足8电子稳定结构 | |
| B. | 对应原子半径:Z<W<R | |
| C. | W与X、W与Y形成的化合物化学键类型完全相同 | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是烃的衍生物 | B. | 它是含有三种元素的混合物 | ||
| C. | 它的相对分子质量为32 | D. | 它在空气中燃烧只生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 与E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
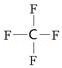
 ,1molO22+中含有的π键数目为2NA.
,1molO22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 100mL 盐酸 | 100mL 盐酸 | 100mL 盐酸 | |
| m(混合物) | 14.2g | 25g | 27.6g |
| V(CO2)(标况) | 3.36L | 4.48L | 4.48L |
| A. | 盐酸的物质的量浓度为3.0mol•L-1 | |
| B. | 加入混合物14.2g时盐酸不足 | |
| C. | 加入25g混合物时盐酸过量 | |
| D. | 根据表中数据计算出混合物中NaHCO3与KHCO3的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com