
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是
A. Y与X可以分别形成原子个数比为1:1、1:2、1:3、1:4的化合物
B. 最高价氧化物对应的水化物酸性:Y>Z>W
C. 原子半径:X<Y<Z<W
D. 简单离子半径:W>Z
【答案】A
【解析】Z的单质是空气中含量最高的气体,Z为N元素;X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,X为第一周期的H元素;W单质制得的金属容器常温下可盛装浓硫酸,W为Al元素;W原子最外层比Y原子最外层少1个电子,Y为C元素。A项,Y与X可形成原子个数比为1:1(如C2H2、苯等)、1:2(如C2H4等单烯烃)、1:3(CH3CH3)、1:4(CH4)的化合物,A项正确;B项,根据同周期从左到右最高价氧化物对应水化物酸性依次增强,同主族从上到下最高价氧化物对应水化物酸性依次减弱,最高价氧化物对应水化物的酸性:Z![]() Y
Y![]() W,B项错误;C项,根据“层多径大,序大径小”,原子半径:X
W,B项错误;C项,根据“层多径大,序大径小”,原子半径:X![]() Z
Z![]() Y
Y![]() W,C项错误;D项,W和Z的简单离子具有相同电子层结构,根据“序大径小”,简单离子半径:Z
W,C项错误;D项,W和Z的简单离子具有相同电子层结构,根据“序大径小”,简单离子半径:Z![]() W,D项错误;答案选A。
W,D项错误;答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和 Na+。某同学为确定其组分,设计并完成了如下实验:

由此可推测原溶液中
A. SO42-、NH4+和Na+一定存在,CO32-一定不存在
B. SO42-、NH4+一定存在,Na+和CO32-一定不存在
C. c(Fe3+)=0.1 molL-1
D. c(Cl-)≥0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗名与化学式相对应的是( )
A.生石灰﹣Ca(OH)2
B.石膏﹣Na2SO410H2O
C.水玻璃﹣Na2SiO3水溶液
D.纯碱﹣NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的四种有机物:①乙烯、②苯、③乙酸、④葡萄糖。其中,属于食醋主要成分的是_____(填序号,下同),作有机溶剂的是_____,可作植物生长调节剂的是_____,可用于医疗输液补充能量的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ/mol;
CaCO3(s)+2H2(g)的△H=_______kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型储能体系,可充电锂二氧化碳电池被称为“可呼吸电池2.0”,该电池的总反应式为:Li+CO2+O2![]() Li2CO3(未配平).其工作原理如下图所示(放电时产生的碳酸锂固体储存于碳纳米管中,TEGDME是一种有机溶剂)。下列说法中正确的是
Li2CO3(未配平).其工作原理如下图所示(放电时产生的碳酸锂固体储存于碳纳米管中,TEGDME是一种有机溶剂)。下列说法中正确的是
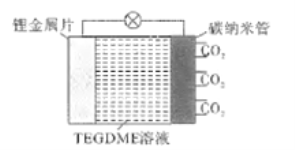
A. 放电时,CO2发生还原反应
B. 若有1.12L.CO2参与反应,则有0.2mol电子发生转移
C. 放电时,Li+从右向左移动
D. 充电时,阳极反应为2Li2CO3-4e-=2CO2↑+O2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com