
【题目】阿司匹林是一种常见药物,它的相对分子质量为180,含C、H、O三种元素,其中含C、H的质量分数分别为60%、4.4%,则阿司匹林的分子式是( )
A.C10H9O4B.C10H22O3C.C9H10O4D.C9H8O4
 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
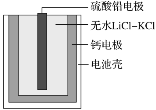
A.放电过程中,Cl-向正极移动
B.正极反应式:PbSO4+2e-=Pb+SO42-
C.反应每转移0.1mol电子,负极理论上消耗4g Ca
D.常温时,在正负极间接上电流表,指针发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是
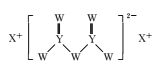
A.原子半径:Z>Y>W
B.化合物M中W的原子满足8电子稳定结构
C.对应单质的熔点:X>Z>Y
D.Z的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
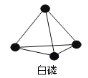
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 可以写成
可以写成![]() 。有机物A的结构如下图所示,请回答:
。有机物A的结构如下图所示,请回答:

(1)有机物A分子所含官能团的名称为__________________。
(2)1mol A最多与____mol H2在一定条件下反应可生成环烃B。
(3)有机物A的分子式为_____________________________。
(4)有机物C是A的同分异构体,属于芳香烃,且C在一定条件下可发生聚合反应,生成高分子化合物D。则C的结构简式为______________,D的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列与转化关系,回答有关问题:
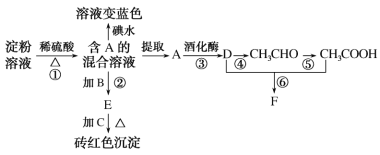
已知:CH3CHO在一定条件下可被氧化为CH3COOH。
(1)A的结构简式为_____,C试剂是_____(填化学式)。
(2)B溶液的作用是_____。
(3)④反应的化学方程式及反应类型分别为_____。
(4)由图示转化关系可知淀粉_____(填“部分水解”或“完全水解”)。某同学取图中混合液E,加入碘水,溶液不变蓝色,______(填“能”或“不能”)说明淀粉水解完全,原因是_____。
(5)以葡萄糖为燃料的微生物燃料电池如图所示,该电池_____(填“能”或“不能”)在高温下工作,酸性条件下负极电极反应的方程式_____。
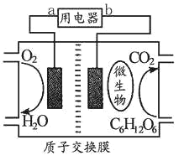
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
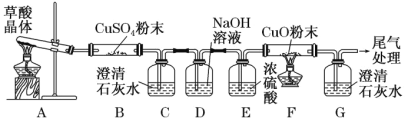
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO![]()
![]() 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )
A.充电时,阴极反应式为:SO![]() +4H++PbO2+2e﹣═PbSO4+2H2O
+4H++PbO2+2e﹣═PbSO4+2H2O
B.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com