
| A、氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O |
| B、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ |
| C、氯化亚铁溶液中滴入氯水:2Fe2++Cl2═2Fe3++2Cl- |
| D、氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |


科目:高中化学 来源: 题型:
| A、水玻璃和亚硫酸钠长期暴露在空气中均易变质 |
| B、浓硝酸和氯水均用棕色试剂瓶保存 |
| C、NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
| D、浓硫酸和浓盐酸长期暴露在空气中浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A、该反应的△H>0 |
| B、加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C、工业上采用5×103kPa和250℃的条件,其原因是原料气的转化率高 |
| D、t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:l | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
B、256g S8分子中含S-S键为7NA个  |
| C、由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D、1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4?7H2O进行消毒、净化,以改善水质 |
| B、铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等 |
C、 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
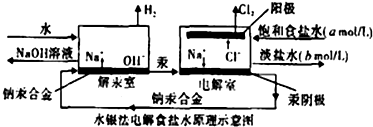 水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )
水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )| A、钠汞合金中钠的化合价为+1价 |
| B、电解室中产生氯气的电极为阳极,产生氢气的电极为阴极 |
| C、当阳极产生3.36 m3(标准状况)Cl2时,解汞室中生成NaOH的质量为24kg |
| D、目前氯碱生产采用离子膜法取代了水银法,其主要原因是汞有毒性,对环境有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
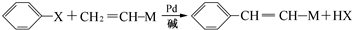 (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: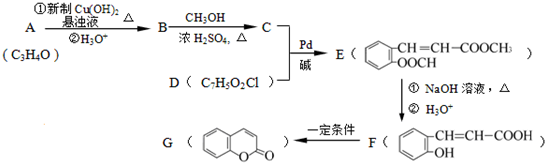
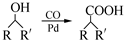 (R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成 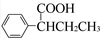 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
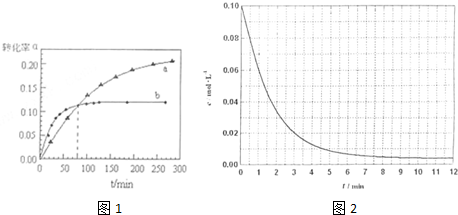
| △n(40℃) |
| △n(60℃) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com