
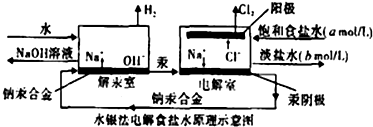
 水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )
水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )| A、钠汞合金中钠的化合价为+1价 |
| B、电解室中产生氯气的电极为阳极,产生氢气的电极为阴极 |
| C、当阳极产生3.36 m3(标准状况)Cl2时,解汞室中生成NaOH的质量为24kg |
| D、目前氯碱生产采用离子膜法取代了水银法,其主要原因是汞有毒性,对环境有污染 |
| ||


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液 |
| B、用广泛pH试纸测出某盐酸溶液的pH为3.2 |
| C、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小 |
| D、实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O |
| B、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ |
| C、氯化亚铁溶液中滴入氯水:2Fe2++Cl2═2Fe3++2Cl- |
| D、氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78Se和80Se互为同素异形体 |
| B、78Se和80Se互为同位素 |
| C、78Se和80Se分别含有34个中子和46个质子 |
| D、78Se和80Se的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
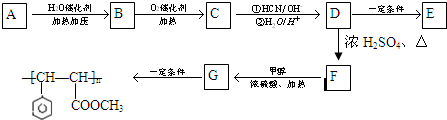
| ①HCN/OH- |
| ②H2O/H+ |
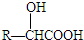
查看答案和解析>>
科目:高中化学 来源: 题型:
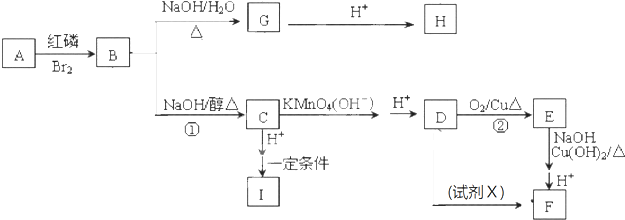
| 红磷 |
| Br2 |
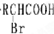
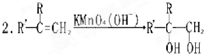
| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
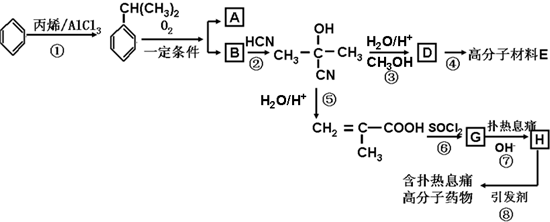
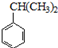 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色;反应②为加成反应
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色;反应②为加成反应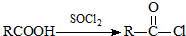
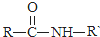
| NaOH溶液 |
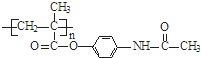
 属于芳香烃的同分异构体的同系物制备
属于芳香烃的同分异构体的同系物制备 的合成路线,
的合成路线,| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com