
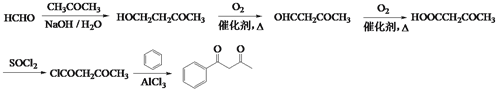
【题目】化合物H是一种用于合成药物的中间体,其合成路线流程图如下:

(1)B中的含氧官能团名称为羟基、________________和________________。
(2)B→C的反应类型为________________。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①含有苯环,且遇FeCl3溶液不显色;
②能发生水解反应,水解产物之一能发生银镜反应,另一水解产物分子中只有3种不同化学环境的氢。
(4)F 的分子式为C18H20O4,写出F的结构简式:________________。
(5)以苯、甲醛和丙酮为基础有机原料,制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________
【答案】 醚键 羰基 消去反应 ![]()

【解析】(1)B为 ,含氧官能团名称为羟基、醚键和羰基;(2)B→C是
,含氧官能团名称为羟基、醚键和羰基;(2)B→C是 加热条件下发生消去反应生成
加热条件下发生消去反应生成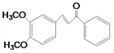 和水,反应类型为消去反应;(3)A(
和水,反应类型为消去反应;(3)A(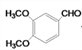 )的同分异构体满足:①含有苯环,且遇FeCl3溶液不显色,则不含有酚羟基;②能发生水解反应,水解产物之一能发生银镜反应,另一水解产物分子中只有3种不同化学环境的氢,则应高度对称,考虑氧原子的个数,应该含有甲酸酯结构,则符合条件的结构简式有
)的同分异构体满足:①含有苯环,且遇FeCl3溶液不显色,则不含有酚羟基;②能发生水解反应,水解产物之一能发生银镜反应,另一水解产物分子中只有3种不同化学环境的氢,则应高度对称,考虑氧原子的个数,应该含有甲酸酯结构,则符合条件的结构简式有![]() ;(4)F 的分子式为C18H20O4,结合E(
;(4)F 的分子式为C18H20O4,结合E(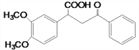 )的结构简式,以及F与SOCl2反应生成
)的结构简式,以及F与SOCl2反应生成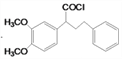 ,则F的结构简式为:
,则F的结构简式为: ; (5)甲醛与丙酮在氢氧化钠溶液中反应生成HOCH2CH2COCH3,HOCH2CH2COCH3催化氧化得到OHCCH2COCH3,OHCCH2COCH3进一步催化氧化得到HOOCCH2COCH3,HOOCCH2COCH3与SOCl2反应得到ClCOCH2COCH3,ClCOCH2COCH3与苯在氯化铝催化下反应得到
; (5)甲醛与丙酮在氢氧化钠溶液中反应生成HOCH2CH2COCH3,HOCH2CH2COCH3催化氧化得到OHCCH2COCH3,OHCCH2COCH3进一步催化氧化得到HOOCCH2COCH3,HOOCCH2COCH3与SOCl2反应得到ClCOCH2COCH3,ClCOCH2COCH3与苯在氯化铝催化下反应得到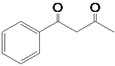 。合成路线流程图如下:
。合成路线流程图如下:![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________,氧化产物是______。
(3)“碱浸”时生成CO2的电子式为_______,碱浸”时含钼化合物发生的主要反应的离子方程式为_____。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为______。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为_____%。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
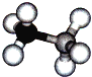
(1)氨硼烷的晶体类型为__.
(2)氮和硼比较,电负性大的元素为__(填元素符号).
(3)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为__和__.
(4)氨硼烷__(填“能”或“不能”)溶于水,其原因是__.
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
该配合物中镍离子的基态电子排布式为__.该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是_____________。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。lmolNH4BF4含有______mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________,原因为_______________________。

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________,σ键和π键数目之比为__________。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为________,Cu3N的密度为________g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用20gNaOH配成250mL溶液,它的物质的量浓度为 ______
用20gNaOH配成250mL溶液,它的物质的量浓度为 ______ ![]() 取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______
取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______ ![]() 该100mL溶液可以跟
该100mL溶液可以跟![]() 的硫酸溶液 ______ mL完全中和生成
的硫酸溶液 ______ mL完全中和生成![]() .
.
![]() 气态化合物A的化学式可以表示为
气态化合物A的化学式可以表示为![]() ,已知同温同压下10mLA受热完全分解生成
,已知同温同压下10mLA受热完全分解生成![]() 和10mL
和10mL![]() ,则A的化学式为 ______ .
,则A的化学式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、同温同压下,若A容器中充满O2、B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是_____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是____。
Ⅱ、现有14.4g一氧化碳和二氧化碳的混合气体,在标准状况下其体积为8.96L。
请回答下列问题:
(1)该混合气体的平均摩尔质量为____。
(2)混合气体中碳原子的个数为____(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。

气球中收集到的气体的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、Ⅹ、Y、Z的原子序数依次增加。A是元素Y的单质。常温下A遇甲的浓溶液钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是

A. 丁和戊中所含化学键类型完全相同
B. 简单离子的半径大小:X>Y
C. 简单阴离子的还原性:X>Z
D. Y与Z的简单化合物不与水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com