
【题目】环保部门检测到某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,要求该工厂从该废水中回收硫酸亚铁和金属铜。该工厂设计了如下流程图,完成回收硫酸亚铁和铜的简单实验方案。
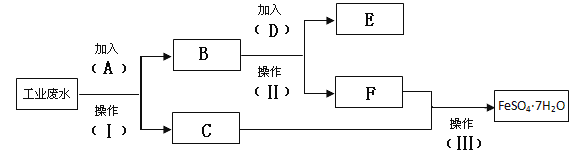
回答下列问题
(1)填写试剂A的化学式 _______________
(2)假如加入2mol D刚好完全反应,此步转移的电子的物质的量为 __________
(3)写出加入A的离子方程式: _________________
(4)操作Ⅱ和III 的名称分别是 ___________、 ____________、________
【答案】Fe 4mol Fe+Cu2+=Fe2++Cu 过滤 蒸发浓缩 冷却结晶
【解析】
工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,A为Fe,将铜置换出来,操作Ⅰ为过滤,C为滤液,且C中含FeSO4,则B中含Cu及过量的Fe,加入D为稀硫酸将过量的Fe反应掉,操作Ⅱ为过滤,则E为Cu, F中主要含硫酸亚铁,F、C混合液中主要含FeSO4,操作III为蒸发浓缩、冷却结晶、过滤后可得到FeSO4.7H2O,以此来解答。
(1)试剂A与Cu2+反应置换生成铜,A的化学式Fe;
(2)假如加入2mol D刚好完全反应,根据反应Fe+H2SO4=FeSO4+H2↑,每个氢离子转移一个电子,则2mol H2SO4转移电子的物质的量为4mol;
(3)加入的A与Cu2+反应置换生成铜,离子方程式为:Fe+Cu2+=Fe2++Cu;
(4)操作Ⅱ是将铜过滤出来,操作III 是由溶液中得到FeSO4.7H2O,名称是:蒸发浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量的热。实验室采用如图装置制备无水MgBr2。下列说法错误的是
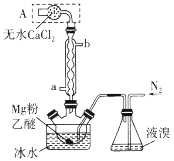
A.a为冷却水进水口
B.装置A的作用是吸收水蒸气和挥发出的溴蒸气
C.实验时需缓慢通入N2,防止反应过于剧烈
D.不能用干燥空气代替N2,因为副产物MgO会阻碍反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4s时测得各物质的浓度如表,则下列判断正确的是
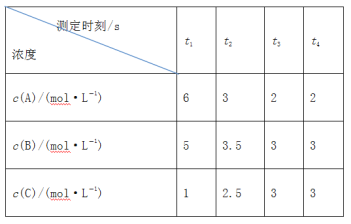
A.在t3s时反应已经停止
B.t3~t4s内正、逆反应速率不相等
C.在容器中发生的反应为A(g)+B(g)![]() C(g)
C(g)
D.在t2~t3s内A的平均反应速率为![]() mol·L1·s1
mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
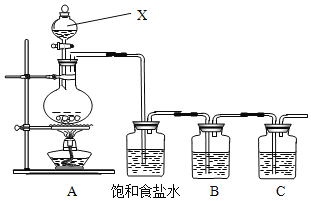
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验室制取气体的反应中,其反应不属于氧化还原反应的是( )
A.实验室中用稀硫酸与Mg反应制取H2B.实验室中用高锰酸钾加热分解制取O2
C.实验室中用H2O2与MnO2作用产生O2D.实验室中用稀盐酸与石灰石反应制取CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是
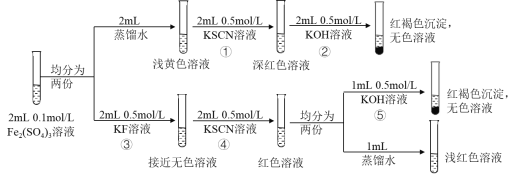
A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图:
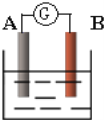
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为_______极(填正或负),写出电极反应式:正极_______,负极_______.总反应离子方程式为:_______。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为_______极(填正或负),写出电极反应式:正极_______,负极_______.总反应离子方程式为:_______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的_______极(填正或负),写出电极反应式:正极______________,负极______.总反应方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
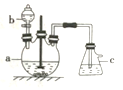
①在仪器a中先加入20g铜片、60 mL水,再缓缓加入17 mL浓硫酸:在仪器b中加入39 mL浓硝酸;在仪器c中加入20%的石灰乳150 mL。
②从仪器b中放出约5mL浓硝酸,开动搅拌器然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片溶液冷却至室温.析出蓝色晶体.回答下列问题:
(1)将仪器b中液体滴入仪器a中的具体操作是__________。
(2)写出装置a中生成CuSO4的化学方程式:_______。
(3)步骤②电炉加热直至仪器a中的红棕色气体完全消失,此时会产生的气体是______,该气体无法直接被石灰乳吸收,为防止空气污染,请画出该气体的吸收装置(标明所用试剂及气流方向)______。
(4)通过本实验制取的硫酸铜晶体中常含有少量Cu(NO3)2,可来用重结晶法进行提纯,检验Cu(NO3)2是否被除净的方法是_______。
(5)工业上也常采用将铜在450 °C左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法,对比分析本实验采用的硝酸氧化法制取CuSO4的优点是_______。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成100 mL溶液,每次取20.00 mL用c mol·L-1EDTA(H2Y )标准溶液滴定至终点,平行滴定3次,平均消耗EDTA溶液b mL,滴定反应为Cu2++H2Y =CuY +2H+,蓝色晶体中Cu2+质量分数![]() _____%.
_____%.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com