
【题目】在容积为1 L的密闭容器中,加入1.0 mol A和2.2 mol B进行如下反应:A(g) + 2B(g) ![]() C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
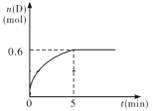
(1)800℃时,0~5 min内,以B表示的平均反应速率为____________。
(2)利用图中数据计算在800 ℃时的平衡常数的数值为___________。
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为_________反应(填“吸热”或“放热”)。
(4)800 ℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol·L-1,c(B)=0.50 mol·L-1,c(C)=0.20 mol·L-1,c(D)=0.018 mol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
【答案】(8分)
(1)0.24mol·L-1·min-1(2分,单位1分)
(2)0.9(2分)
(3)吸热(2分)
(4)向正方向进行(2分)
【解析】
试题分析:
(1)v(D)=![]() =
=![]() =0.12mol/(Lmin),该反应中,v(B)=2v(D)=0.24mol/(Lmin);
=0.12mol/(Lmin),该反应中,v(B)=2v(D)=0.24mol/(Lmin);
(2)反应达到平衡状态时,c(D)=![]() =0.6mol/L,c(C)=c(D)=0.6mol/L,
=0.6mol/L,c(C)=c(D)=0.6mol/L,
c(A)=![]() =0.4mol/L,c(B)=
=0.4mol/L,c(B)=![]() =1 mol/L,K=
=1 mol/L,K=![]() =
=![]() =0.9。
=0.9。
(3)根据上述计算,可知800 ℃平衡时A的浓度为0.4mol/L,700℃平衡时A的浓度为0.55mol/L,则温度降低,A的浓度增大,平衡逆向移动,则该反应为吸热反应。
(4)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向逆反应方向移动,如果浓度商小于化学平衡常数,则反应向正反应方向移动;Qc=(0.2×0.018)÷(0.06×0.502)=0.24<0.9,则平衡向正反应方向移动。


科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
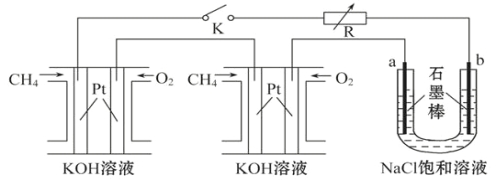
回答下列问题:
(1)甲烷燃料电池正极的电极反应为________________、负极的电极反应____________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________,电解氯化钠溶液的总反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. 增加X的物质的量,Y的转化率降低
C. 降低温度,混合气体的平均相对分子质量变小
D. X的正反应速率是Y的逆反应速率的m/n倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示:
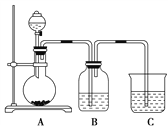
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________,C中可观察到的现象是________。
(2)B装置的作用是______________。
(3)根据实验现象推知,碳酸、硝酸、原硅酸的酸性强弱顺序是________,由此得出碳、氮、硅三种元素非金属性的强弱顺序是________________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯元素和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:__________________________。
(5)C装置的作用是_______________________。
(6)实验结论:氧化性:________,非金属性:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B. 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D. 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:X+4HNO3===PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是________,PbO2不是碱性氧化物,判断的依据是_________________________________________________。
②X的化学式是________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为____________________________________________。
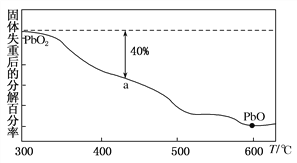
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体。若a点固体组成表示为PbOx,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. ![]() 的溶液中:Na+、K+、AlO2-、NO3-
的溶液中:Na+、K+、AlO2-、NO3-
B. 含有大量Fe3+的溶液中:NH4+、I-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42-、NO3-
D. 0.1mol·L-1Na2SO3的溶液中:H+、Ca2+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:
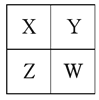
若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
④若四种元素只有一定为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中不正确的说法有几项
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com