
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:X+4HNO3===PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是________,PbO2不是碱性氧化物,判断的依据是_________________________________________________。
②X的化学式是________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为____________________________________________。
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体。若a点固体组成表示为PbOx,则x=________。
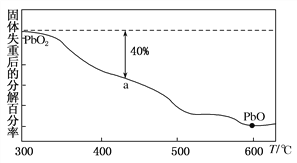
【答案】 +4 PbO2不能与硝酸反应生成盐与水 Pb3O4 PbO+ClO-===PbO2+Cl- 1.6
【解析】试题分析(1) ①根据化合价代数和等于0计算元素化合价;碱性氧化物与酸反应只能生成盐和水;②根据元素守恒判断X的化学式;(2) PbO被次氯酸钠氧化为PbO2;(3)根据元素守恒计算x值。
解析:①根据化合价代数和等于0,PbO2中Pb元素的化合价为+4;碱性氧化物与酸反应只能生成盐和水,PbO2不能与硝酸反应生成盐与水,所以PbO2不是碱性氧化物;②X+4HNO3===PbO2+2Pb(NO3)2+2H2O,根据元素守恒,X的化学式为Pb3O4;(2) PbO被次氯酸钠氧化为PbO2,离子方程式为PbO+ClO-===PbO2+Cl-;(3)根据元素守恒,设原PbO2的物质的量为1mol,a点样品分解40%,则生成PbO 0.4mol,剩余PbO2 0.6mol,所以Pb原子的物质的量为1mol、O原子的物质的量为1.6mol,则PbOx的组成为PbO1.6,x=1.6。


科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A. 一定条件下某密闭容器盛2 mol N2与3 mol H2反应生成的NH3分子数为2NA
B. 25 ℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C. 一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO![]() 和CO
和CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,加入1.0 mol A和2.2 mol B进行如下反应:A(g) + 2B(g) ![]() C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
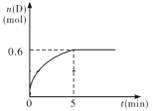
(1)800℃时,0~5 min内,以B表示的平均反应速率为____________。
(2)利用图中数据计算在800 ℃时的平衡常数的数值为___________。
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为_________反应(填“吸热”或“放热”)。
(4)800 ℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol·L-1,c(B)=0.50 mol·L-1,c(C)=0.20 mol·L-1,c(D)=0.018 mol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 干冰可用于人工降雨 B. 碘酸钾可用作加碘食盐的添加剂
C. 碳酸钠是发酵粉的主要成分 D. 次氯酸钙是漂白粉的有效成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
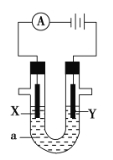
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极).下列说法正确的是
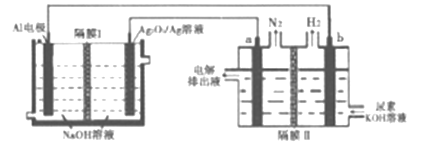
A. Ag电极是正极,反应后该电极区溶液pH减小
B. 原电池的总反应为:2Al+3Ag2O2+2NaOH=2NaAlO2+3Ag2O+H2O
C. a电极上的电极反应为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
D. 每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO--)(填“>”、“=”或“<”,下同)。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+) = c(CH3COO--),则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(3)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO--)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com