
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,如下措施中①向盐酸中加少量水;②将铁粉换成铁片;③升高温度:④将盐酸换成与之等体积等浓度的硫酸,能达到目的有( )
A.②④B.①②C.②③D.①④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按以下框图进行反应。又知E溶液是无色的,请回答: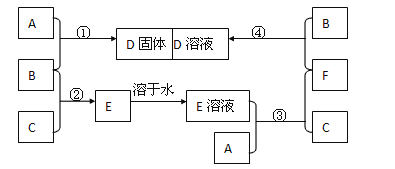
(1)A是、B是、C是(请填化学式)。
(2)反应①的化学方程式为:。
(3)反应③的化学方程式为:。
(4)反应④的化学方程式为:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3 , 还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下: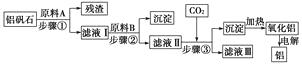
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,不正确的是( )
A.铝矾石中只含有金属氧化物
B.铝矾石与河沙含有相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中不涉及置换反应
(2)原料A的名称是 , 步骤①用到的主要玻璃仪器有。
(3)滤液Ⅰ中要加入稍过量的原料B,原料B的化学式是 , 步骤②反应的离子方程式为。
(4)在步骤③中(填“能”或“不能”)用盐酸代替CO2 , 原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述不正确的是( )
A.标准状况下,22.4 L的CCl4中所含质子数为74 NA
B.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
C.12 g石墨晶体中含有的碳碳键数目为1.5 NA
D.分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃ 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ gcm﹣3 , 溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w= ![]() ×100%
×100%
B.溶质的物质的量浓度c= ![]() ?mol?L﹣1
?mol?L﹣1
C.溶液中c(OH﹣)= ![]() ?mol?L﹣1
?mol?L﹣1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A.![]() mol?L﹣1
mol?L﹣1
B.![]() mol?L﹣1
mol?L﹣1
C.![]() mol?L﹣1
mol?L﹣1
D.![]() mol?L﹣1
mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5%KSCN溶液、pH=4的HAc-NaAC缓冲溶液、1∶1HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 ml容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
Ⅰ.配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL5%KSCN溶液和2.5 mLpH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
Ⅱ.制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL1∶1 HNO3溶液,小心加热2~3 min。冷却后,全部移入100 mL容量瓶中,再加入4.0 mL5%KSCN溶液和10.0 mLpH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL待测液加入与Ⅰ中相同规格的比色管中。
Ⅲ.比色:将Ⅱ所得比色管中的溶液与Ⅰ中各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显色。
(2)完成该实验,还缺少的仪器有、。
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是?
(4)实验中量取HNO3溶液、HAc-NaAc缓冲溶液用量筒即可,原因是?
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是?
(6)若测得待测液中Fe3+的物质的量浓度为c mol/L,药片的质量为m , 则药片中铁元素的质量分数为?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com