
【题目】下列离子的组合为无色溶液且可以大量共存的是
A. Na+ 、NH4+ 、NO3-、MnO4- B. K + 、Ag+ 、Cl-、Br-
C. K +、SO42-、OH-、AlO2- D. Ba2+ 、Na+ 、OH-、CO32-
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图 I、II为中学化学中的常见装置,但均有缺陷,根据如图实验装置回答问题: 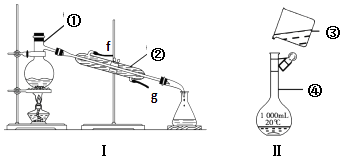
(1)写出下列仪器的名称:① , ④ .
(2)现利用装置Ⅰ分离下列混合物,可行的是 . A.NaCl和KNO3 B.酒精和水 C.NaCl和泥沙 D.NaCl溶液和四氯化碳
要达到上述实验目的,还缺少的仪器有 , 进行实验操作时②仪器的进水口是(填“f”或“g”).
(3)现需配制1L 0.50mol/L 的稀盐酸,装置Ⅱ是某同学转移溶液的示意图, ①指出图中的错误之处:
②实验室用36.5%的浓盐酸(密度为1.19g/cm3)配制上述溶液. 需量取浓盐酸的体积是mL.
③下列操作会使所配盐酸浓度偏小的是
A.用胶头滴管加水定容时,有少量水滴到容量瓶外
B.定容时仰视观察液面
C.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
D.容量瓶中原有少量蒸馏水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从南方往北方长途运输水果时,常常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
A. 利用酸性高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B. 利用酸性高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C. 利用酸性高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D. 利用睃性髙锰酸钾溶液的氧化性,催熟水果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某NaCl溶液中含有0.5molNa+ , 对该溶液的说法不正确的是( )
A.配制100mL该溶液需用5.85g NaCl
B.该溶液的物质的量浓度为1molL ﹣1
C.该溶液中含有58.5g NaCl
D.量取100mL该溶液,其中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)C(s)△H<0,按照不同配比充入A,B,达到平衡时容器中A,B浓度变化如图中曲线(实线)所示,下列判断正确的是( ) 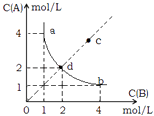
A.T°C时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T°C
D.T°C时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
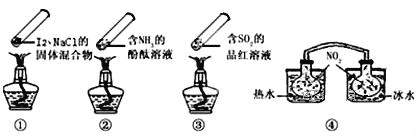
A. 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B. 加热时,②、③中的溶液均变红,冷却后又都变为无色
C. ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D. 四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
A.3.4mol/L
B.0.2mol/L
C.1.8mol/L
D.3.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 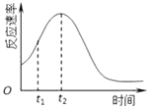
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求填空:
①第三周期中有两个成单电子的元素符号是________;
②四核10电子的粒子的电子式(写一种)__________;
③第四周期中,3d轨道半充满的元素符号是________________。
(2)下列物质中:①白磷(P4) ②水晶 ③氯化铵 ④氢氧化钙 ⑤氟化钠 ⑥过氧化钠 ⑦石墨,固态下都为晶体,回答下列问题(填写序号):
不含金属离子的离子晶体是________,只含离子键的离子晶体是________,既有离子键又有非极性键的离子晶体是________,既有离子键又有极性键的离子晶体是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com